Ⅰ.化學實驗是中學化學學習中必不可少的一環。根據要求,回答下列問題。

(1)在測定中和反應的反應熱時,如圖所示:
①儀器a的名稱為 環形玻璃攪拌器環形玻璃攪拌器。
②某同學每次分別取0.50mol?L-150mLNaOH溶液和0.50mol?L-130mL硫酸進行實驗,通過多次實驗測定中和熱的測量值為53.5kJ?mol-1,與57.3kJ?mol-1有偏差,產生偏差的原因可能是 abdabd(填字母)。
a.實驗裝置保溫、隔熱效果差
b.用金屬攪拌器代替玻璃攪拌器
c.一次性快速把NaOH溶液倒入盛有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定硫酸溶液的溫度
(2)在進行酸堿中和商定實驗時:
①滴定管的使用。在使用滴定管前,要 檢查滴定管是否漏水(或檢漏)檢查滴定管是否漏水(或檢漏)。
②用0.1000mol?L-1NaOH溶液滴定未知濃度的HCl溶液,用酚酞溶液作指示劑,達到滴定終點時的現象是 當滴入最后半滴標準NaOH溶液時,溶液由無色變為淺紅色,半分鐘內不褪色當滴入最后半滴標準NaOH溶液時,溶液由無色變為淺紅色,半分鐘內不褪色。
③排出堿式滴定管中氣泡的方法應采用如圖所示操作中的 丙丙,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。

④讀取盛裝0.1000mol/LNaOH溶液的 堿式滴定管堿式滴定管(填儀器名稱)的初始讀數。如果液面位置如圖所示,則此時的讀數為 1.701.70mL。

Ⅱ.常溫下,有關4種溶液的信息如下:
| 編號 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
| pH | 11 | 11 | 3 | 3 |
請回答下列問題:
(3)取等體積的溶液①與④混合后,所得溶液呈
堿
堿
性。(填“酸”“中”或“堿”)(4)將aL溶液②與bL溶液④混合后,若所得溶液的pH=4(忽略溶液混合的體積變化),則a:b=
9:11
9:11
。【答案】環形玻璃攪拌器;abd;檢查滴定管是否漏水(或檢漏);當滴入最后半滴標準NaOH溶液時,溶液由無色變為淺紅色,半分鐘內不褪色;丙;堿式滴定管;1.70;堿;9:11
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/9/25 1:0:2組卷:5引用:1難度:0.6
相似題
-
1.在測定中和熱的實驗中,下列說法正確的是( )
A.在測定中和熱實驗中需要使用的儀器有:天平、量筒、燒杯、溫度計、玻璃棒 B.完成一次中和反應反應熱測定實驗,溫度計需要使用2次,分別用于測混合液的初始溫度和反應最高溫度 C.用50mL0.55mol/L的NaOH溶液與60mL0.50mol/L的鹽酸反應,測得的中和熱數值偏大 D.使用環形玻璃攪拌棒是為了使反應物充分混合減小實驗誤差 發布:2024/12/18 23:0:1組卷:88引用:2難度:0.7 -
2.掌握化學實驗技能是進行科學探究的基本保證。下列有關說法正確的是( )
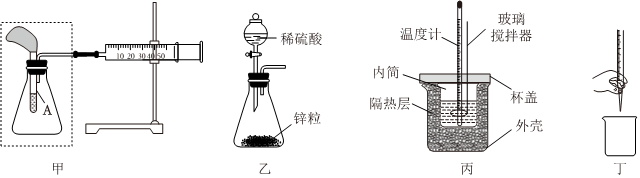
A.若將甲中注射器的活塞往右拉,能自動恢復到原位,說明甲裝置氣密性好 B.將甲虛線框中的裝置換為乙裝置,滴入稀硫酸后若注射器活塞右移,說明鋅與硫酸反應為放熱反應 C.用丙裝置進行中和反應反應熱的測定實驗時,NaOH要緩慢倒入稀硫酸中 D.丁裝置是排出堿式滴定管中的氣泡操作 發布:2024/12/17 3:0:1組卷:94引用:4難度:0.7 -
 3.實驗題:50mL0.50mol?L-1鹽酸與50mL0.55mol?L-1NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱,回答下列問題:
3.實驗題:50mL0.50mol?L-1鹽酸與50mL0.55mol?L-1NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱,回答下列問題:
(1)從實驗裝置上看,圖中缺少的一種玻璃儀器是。
(2)寫出表示該反應中和熱的熱化學方程式(中和熱為57.3kJ?mol-1):(用離子方程式表示)。
(3)實驗中改用60mL0.50mol?L-1鹽酸與60mL0.55mol?L-1NaOH溶液進行反應,與上述實驗相比,所放出的熱量(填“相等”或“不相等”),所求得的中和熱(填“相等”或“不相等”)。
(4)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會(填“偏大””、“偏小””或“無影響”)。
(5)若三次平行操作測得數據中起始時鹽酸與燒堿溶液平均溫度相同,而終止溫度與起始溫度差(t2~t1)分別為①3.3℃、②3.5℃、③4.5℃,則最終代入計算式的溫差平均值為℃。計算該實驗測得的中和反應反應熱ΔH=(結果保留一位小數)[已知Q=cmΔt,設鹽酸和NaOH溶液的密度為1g/cm3,反應后混合溶液的比熱容(c)為4.18J/(g?℃)]。發布:2024/12/4 11:30:1組卷:60引用:3難度:0.6


