氯堿工業是化工產業的重要基石,其裝置示意圖如圖1所示。已知pH升高時,ClO-易歧化為ClO-和Cl-。
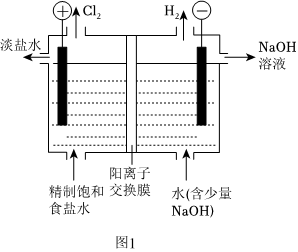
(1)電解飽和食鹽水的離子方程式為 2Cl-+2H2O 通電 H2↑+Cl2↑+2OH-2Cl-+2H2O 通電 H2↑+Cl2↑+2OH-。
(2)陰極生成22.4LH2(折合成標準狀況)時,有 22molNa+穿過交換膜向 陰陰極遷移(選填“陰”或“陽”)。
(3)ClO-3中Cl-采取 sp3sp3雜化,ClO-3離子的空間構型是 三角錐三角錐形。副產物ClO-3的產生有兩種可能途徑:
①Cl-在電極上放電形成ClO-3。寫出該電極反應方程式:Cl--6e-+3H2O=ClO-3+6H+Cl--6e-+3H2O=ClO-3+6H+。
②陽離子交換膜破損導致OH-向陽極室遷移,發生2步反應最終產生ClO-3:Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O,3ClO-=Cl-+ClO-33ClO-=Cl-+ClO-3。
(4)測定副產物ClO-3含量的方法如圖2所示。

①加入H2O2的目的是除去水樣中殘留的Cl2和ClO-。若測定中未加入H2O2,則測得水樣中ClO-3的濃度將 偏大偏大(選填“偏大”“偏小”或“無影響”)。
②滴定至終點時,消耗V3mL酸性KMnO4溶液,則水樣中c(ClO-3)=xV2-5yV36V1xV2-5yV36V1mol?L-1。
通電
通電
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
C
l
O
-
3
x
V
2
-
5
y
V
3
6
V
1
x
V
2
-
5
y
V
3
6
V
1
【考點】氯堿工業;探究物質的組成或測量物質的含量.
【答案】2Cl-+2H2O H2↑+Cl2↑+2OH-;2;陰;sp3;三角錐;Cl--6e-+3H2O=+6H+;Cl2+2OH-=Cl-+ClO-+H2O;3ClO-=Cl-+;偏大;
通電
C
l
O
-
3
C
l
O
-
3
x
V
2
-
5
y
V
3
6
V
1
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/9/17 4:0:8組卷:41引用:1難度:0.7
相似題
-
1.2023年8月24日,日本執意將福島核電站核污水排放大海,引起了世界各國的激烈反對,人類將銘記這沉重的一天。海水(主要陽離子為:Na+、Mg2+、Ca2+等)可為人類提供大量的工業原料,在化工生產中發揮著重要的作用。
下面是現代化氯堿工業流程及部分物質溶解度曲線: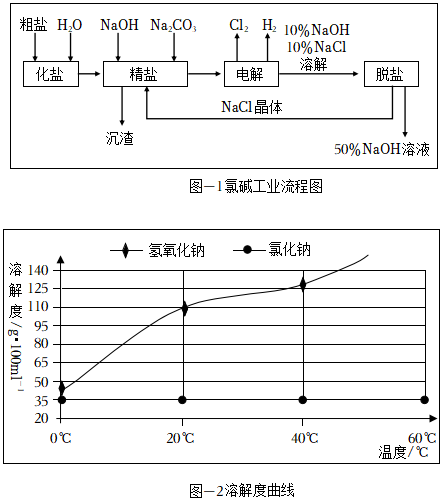
(1)工業制備氯氣的化學反應方程式為:;
(2)制備精鹽溶液過程中會產生沉渣,沉渣的主要成分為;
(3)氯堿工業的主要產物可以直接混合制備消毒劑,且產物是“84消毒液”主要成分,該消毒劑制備的原理是:(寫化學方程式)
(4)“脫鹽”操作可獲取NaCl晶體,同時富集NaOH,請回答:
①獲取NaCl晶體的實驗流程為(填操作名稱)、趁熱過濾、冷水洗滌;
②使用冷水洗滌的目的是:;補充洗滌操作步驟:過濾完畢后,。發布:2024/10/11 18:0:1組卷:34引用:1難度:0.7 -
2.氯堿工業的裝置圖如圖,下列說法正確的是( )
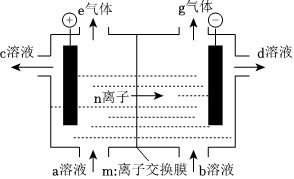
A.m是陰離子交換膜 B.c是濃NaOH溶液 C.陰極的電極反應式:2H+-2e-=H2↑ D.e是氯氣 發布:2024/7/13 8:0:9組卷:59引用:1難度:0.6 -
3.某興趣小組模擬氯堿工業生產原理并探究其產品的性質。已知文獻記載:
氯氣與冷的氫氧化鈉溶液反應生成NaClO;
氯氣與熱的氫氧化鈉溶液反應可生成NaClO和NaClO3。
在酸性較弱時KI只能被NaClO氧化,在酸性較強時亦能被NaClO3氧化。
該小組的實驗過程如下:將0.896L(標準狀況)Cl2通入50.00mL熱的NaOH溶液中,兩者恰好完全反應后,稀釋到250.0ml。
①取稀釋后的溶液25.00mL滴加2mL稀醋酸,加入過量KI溶液。用0.2000mol?L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL時恰好到達終點。
②將上述滴定后的溶液用鹽酸酸化至強酸性,再用上述Na2S2O3溶液滴定到終點,需Na2S2O3溶液30.00mL。
(1)工業上制取氯氣的化學方程式是,氯氣與熱的氫氧化鈉溶液反應的離子方程式為。
(2)在強堿溶液中,NaClO與Fe(OH)3反應生成Na2FeO4,高鐵酸鉀(K2FeO4)具有強氧化性,是一種新型高效水處理劑,它在水處理過程中(鐵元素被還原為+3 價)的兩個作用是、。
(3)在弱酸性溶液中KI被NaClO氧化的離子方程式是在強酸性溶液中KI被NaClO3氧化的離子方程式是。
(4)該滴定應選用的指示劑為。
計算反應后的溶液中氯化鈉和氯酸鈉的物質的量之比(寫計算過程)。發布:2024/6/27 10:35:59組卷:36引用:1難度:0.7


