2023-2024學年上海市南洋模范中學高二(上)月考化學試卷(等級考)
發布:2024/9/17 4:0:8
一、解答題
-
1.金屬鈦密度小、強度高、抗腐蝕性能好,是應用廣泛的金屬。含鈦的礦石主要有金紅石和鈦鐵礦。
(1)基態Ti原子的價層電子排布式為,含有未成對電子個,Ti元素在周期表中的位置是。
(2)將1molTiCl3?4H2O溶于水,加入足量AgNO3溶液,得到1molAgCl沉淀,已知Ti3+的配位數為6,TiCl3?4H2O的化學式用配合物的形式表示為。
金紅石的主要成分是鈦的一種氧化物,該氧化物的晶胞邊長分別為apm,bpm,cpm。結構如圖1所示。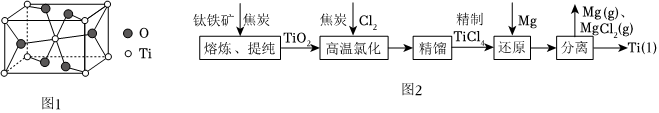
(3)由圖可知該氧化物的化學式是,Ti填充在O構成的空隙中。
A.三角形
B.四面體
C.八面體
(4)該氧化物的熔點為1850℃,其晶體類型最不可能是。
A.共價晶體
B.離子晶體
C.分子晶體
(5)已知mg該氧化物晶體體積為Vcm3,則阿伏加德羅常數NA=。
以鈦鐵礦為原料,用鎂還原法冶煉金屬鈦的工藝流程如圖2所示。
(6)高溫氯化時除TiCl4外還得到一種可燃性氣體,寫出反應的方程式。
(7)結合工藝流程和熔沸點數據,“分離”時所需控制的最低溫度應為℃。
(8)MgCl2的熔點為714℃,而TiCl4的熔點僅為-24.1℃,解釋兩者熔點的差異:Ti Mg MgCl2 熔點/℃ 1668 651 714 沸點/℃ 3287 1107 1412 。組卷:31引用:1難度:0.5
一、解答題
-
4.氯堿工業是化工產業的重要基石,其裝置示意圖如圖1所示。已知pH升高時,ClO-易歧化為ClO-和Cl-。
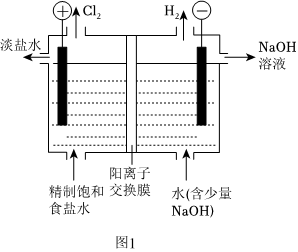
(1)電解飽和食鹽水的離子方程式為。
(2)陰極生成22.4LH2(折合成標準狀況)時,有molNa+穿過交換膜向極遷移(選填“陰”或“陽”)。
(3)中Cl-采取ClO-3雜化,離子的空間構型是ClO-3形。副產物的產生有兩種可能途徑:ClO-3
①Cl-在電極上放電形成。寫出該電極反應方程式:ClO-3。
②陽離子交換膜破損導致OH-向陽極室遷移,發生2步反應最終產生:ClO-3,。
(4)測定副產物含量的方法如圖2所示。ClO-3
①加入H2O2的目的是除去水樣中殘留的Cl2和ClO-。若測定中未加入H2O2,則測得水樣中的濃度將ClO-3(選填“偏大”“偏小”或“無影響”)。
②滴定至終點時,消耗V3mL酸性KMnO4溶液,則水樣中c()=ClO-3mol?L-1。組卷:41引用:1難度:0.7 -
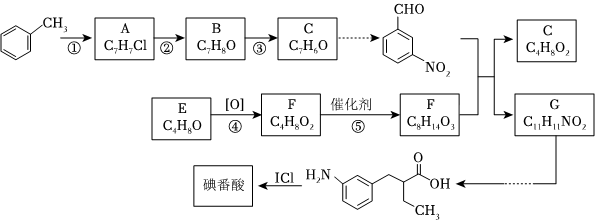
5.碘番酸是一種口服造影劑,其合成路線如圖:
已知: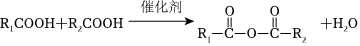
(1)①所需的試劑和反應條件是;⑤的反應類型是。
(2)寫出反應②的化學方程式。
(3)C無法一步轉化為間硝基苯甲醛,其原因是。
(4)E中無支鏈,E的名稱是。D有一種同分異構體,其核磁共振氫譜只有一組峰,該同分異構體的結構簡式是。G中含有乙基,G的結構簡式是。
(5)證明E完全轉化為D的實驗操作是。
(6)設計一條由CH2=CH2合成乳酸[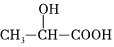 ]的合成路線(無機試劑任選)。
]的合成路線(無機試劑任選)。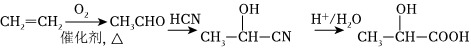 組卷:21引用:1難度:0.3
組卷:21引用:1難度:0.3


