電離平衡常數(用Ka表示)的大小可以判斷電解質的相對強弱。25℃時,有關物質的電離平衡常數如下表所示:
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
HF>H2CO3>HClO
HF>H2CO3>HClO
。物質的量濃度均為0.1mol/L的下列溶液:a.Na2CO3 b.NaClO c.NaHCO3 d.NaF,pH值由大到小的順序是 a>b>c>d
a>b>c>d
(填編號)(2)將濃度為0.1mol/LHF溶液加水稀釋一倍(假設溫度不變),下列各量增大的是
CD
CD
。A.c(H+)
B.c(H+)?c(OH-)
C.
c
(
H
+
)
c
(
HF
)
D.
c
(
OH
-
)
c
(
H
+
)
(3)25℃時,在20mL0.1mol/L氫氟酸中加入VmL0.1mol/LNaOH溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是
BC
BC
。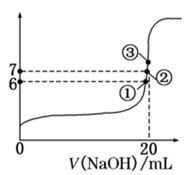
A.pH=3的HF溶液和pH=11的NaF溶液中,由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②點時,溶液中的c(F-)=c(Na+)
D.③點時V=20mL,此時溶液中c(F-)<c(Na+)=0.1mol/L
【考點】酸堿混合時的定性判斷及有關pH的計算.
【答案】HF>H2CO3>HClO;a>b>c>d;CD;BC
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:10引用:1難度:0.6
相似題
-
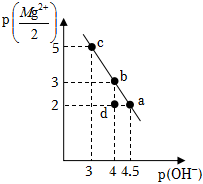 1.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2
1.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2A.a點溶液滿足:2c(Mg2+)+c( )<c(Cl-)NH+4B.b點溶液滿足:c( )>c(Cl-)>c(Mg2+)>c(OH-)NH+4C.c點溶液中通入NH3的量在標準狀況下的體積為22.4mL D.d點溶液中無Mg(OH)2沉淀產生 發布:2024/12/30 4:0:1組卷:23引用:2難度:0.5 -
2.常溫下,在體積均為20mL、濃度均為0.1mol/L的HX溶液、HY溶液中分別滴加0.1mol/L的NaOH溶液,反應后溶液中水電離的c(H+)的負對數[-lgc(H+)水]與滴加氫氧化鈉溶液體積的關系如圖所示。下列推斷正確的是( )
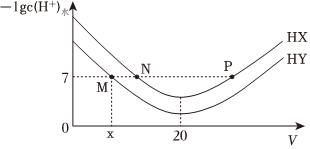
A.HX、HY均為弱酸且HX>HY B.P點溶液中c(Na+ )=c(X-)>c(H+)=c(OH-) C.常溫下用蒸餾水分別稀釋N、P點溶液,溶液pH都變小 D.常溫下,HY的電離常數Ka= x(20-x)×10-7發布:2024/12/15 2:30:7組卷:71引用:4難度:0.6 -
3.下列說法正確的是( )
A.食鹽溶液中除去SO42- 最合適的試劑是Ba(NO3)2 B.NaCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 C.25℃時,用醋酸溶液中和等濃度NaOH溶液至pH=7,VCH3COOH<VNaOH D.AgCl易轉化為AgI沉淀且Ksp(AgX)=[Ag+]?[X-],故Ksp(AgI)<Ksp(AgCl) 發布:2025/1/1 8:0:2組卷:0引用:1難度:0.7


