“綠水青山就是金山銀山”,研究并消除氮氧化物污染對建設美麗家鄉,打造宜居環境有重要意義。
(1)目前可利用以下化學原理解決汽車尾氣:2NO(g)+2CO(g)?2CO2(g)+N2(g)。一定條件下,在容積固定的容器中進行上述反應,CO濃度c(CO)與時間關系如圖所示:
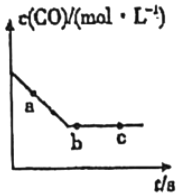
①a、b、c三點的正反應速率明v(a)、v(b)、v(c)的大小關系是 v(a)>v(b)=v(c)v(a)>v(b)=v(c)。
②下列可說明反應到達圖中c點的是 BCBC。
A.NO、CO、CO2、N2的濃度比值保持2:2:2:1不變
B.CO的濃度不再改變
C.反應消耗2molNO的同時消耗1molN2
D.容器中氣體質量不發生變化
(2)用活性炭還原法處理氮氧化物的有關反應為:2NO(g)+C(s)?CO2(g)+N2(g)。向某密閉容器中加入一定量的活性炭和,其反應速率與時間的關系如圖所示,在t1時刻某條件發生改變。
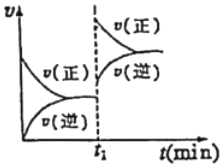
①由圖可判斷該反應為 吸熱吸熱(填“吸熱”或“放熱”)反應。
②一定溫度下,隨著NO的起始濃度增大,則NO的平衡轉化率 不變不變(填“增大”、“不變”或“減小”)。
(3)影響化學反應速率的因素有很多,某課外興趣小組用實驗的方法對其進行探究。取3mol/L的H2O2溶液各10mL分別進行下列實驗,實驗報告如表所示。
| 序號 | V(過氧化氫溶液)/mL | V(氯化鐵溶液)/mL | 二氧化錳質量/g | 反應溫度/℃ | V(水)/mL | 結論 |
| 1 | 10 | 2 | 0 | 50 | 8 | |
| 2 | 10 | 2 | 0 | 30 | 8 | |
| 3 | 10 | 0 | 1 | 30 | a |
溫度
溫度
對H2O2分解速率的影響。②表中數據a的值應該為
10
10
;實驗2、3研究的是 催化劑
催化劑
對H2O2分解速率的影響。【考點】化學反應速率的影響因素;化學平衡的影響因素.
【答案】v(a)>v(b)=v(c);BC;吸熱;不變;溫度;10;催化劑
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:14引用:1難度:0.6
相似題
-
1.下列條件的變化,是因為吸收能量而增加單位體積內的反應物活化分子百分數致使反應速率加快的是( )
A.增大濃度 B.增大壓強 C.升高溫度 D.使用催化劑 發布:2025/1/6 6:0:5組卷:3引用:1難度:0.8 -
2.在恒溫恒容的容器里進行下列反應:N2+3H2?2NH3,其他條件不變,向容器中充入氬氣,則此反應速率會( )
A.變大 B.變小 C.不變 D.無法判斷 發布:2025/1/6 6:0:5組卷:51引用:3難度:0.9 -
3.下列措施能明顯增大原反應的化學反應速率的是( )
A.Na與水反應時增大水的用量 B.恒溫恒容條件下,在工業合成氨反應中,增加氮氣的量 C.在H2SO4與NaOH兩溶液反應時,增大壓強 D.將稀H2SO4改為98%的濃H2SO4與Zn反應制取H2 發布:2025/1/6 6:0:5組卷:9引用:2難度:0.7


