2021-2022學年廣東省茂名市高州市校際高二(上)聯(lián)考化學試卷(11月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小題2分。在每小題給出的四個選項中,只有一項是符合要求的。
-
1.下列分析不正確的是( )
A.“木與木相摩則然(燃)”的“然”是化學能轉變?yōu)闊崮?/label> B.“司烜氏,掌以夫遂(青銅凹鏡) 取明火于日”的“夫遂”是單質 C.“著作酒醴(甜酒),爾惟曲蘗(酒曲)”的“曲蘗”是催化劑 D.“浮梁巧燒瓷,顏色比瓊玖”的“瓷”是硅酸鹽產品 組卷:132引用:8難度:0.9 -
2.下列關于能量變化的說法正確的是( )
A.“冰,水為之,而寒于水”說明相同質量的水和冰相比較,冰的能量高 B.化學反應在物質變化的同時,伴隨著能量變化,其表現(xiàn)形式只有吸熱和放熱兩種 C.已知C(石墨,s)═C(金剛石,s)ΔH>0,則金剛石比石墨穩(wěn)定 D.化學反應遵循質量守恒的同時,也遵循能量守恒 組卷:112引用:37難度:0.9 -
3.下列敘述錯誤的是( )
①Fe、石墨、鹽酸.氫氧化鈉溶液均能導電,所以他們均是電解質
②SO2、NH3溶于水均能導電,所以他們均是電解質
③HCl、NaOH、NaCl、Na2O是電解質,所以他們均能夠導電。
④液態(tài)HCl不導電,所以屬于非電解質
⑤CH3COOH易溶于水,是強電解質,BaSO4難溶于水,是弱電解質
⑥強電解質溶液的導電性一定比弱電解質溶液的導電性強
⑦NaHSO4在熔融狀態(tài)下能電離出三種離子
⑧H2CO3、NaHCO3在溶液中的電離方程式分別為:H2CO3?2H++CO32-;NaHCO3=Na++H++CO32-A.①②③⑤⑥ B.②③④⑤ C.沒有錯 D.全部錯 組卷:17引用:2難度:0.6 -
4.破壞(或形成)1 mol 化學鍵所吸收(或放出)的能量稱為鍵能。已知 H-H 鍵的鍵能為 436 kJ?mol-1,O=O 鍵的鍵能為 498 kJ?mol-1,H2(g)+
O2(g)═H2O(l)△H=-286 kJ?mol-1,則 H2O 分子中 O-H 鍵的鍵能為( )12A.485.5 kJ?mol-1 B.610 kJ?mol-1 C.917 kJ?mol-1 D.1 220 kJ?mol-1 組卷:14引用:6難度:0.5 -
5.對于反應2SO2(g)+O2(g)═2SO3(g)△H<0,下列措施中,既能使正反應速率增大 又能使平衡正向移動的是( )
A.通入大量的O2 B.增大容積的體積 C.移去部分SO3 D.升高體系的溫度 組卷:28引用:3難度:0.5 -
6.下列關于反應能量的說法正確的是( )
A.已知:I2(g)+H2(g)?2HI(g)ΔH=-9.48kJ?mol-1若將1molI2(g)和1molH2(g)置于密閉容器中充分反應后放出熱量為9.48kJ B.已知:H2的燃燒熱為285.8kJ?mol-1。表示氫氣燃燒熱的熱化學方程式為2H2(g)+O2(g)=2H2O(l),ΔH=-571.6kJ?mol-1 C.需要加熱才能發(fā)生的反應一定是吸熱反應 D.已知中和熱為57.3kJ?mol-1,則CH3COOH(aq)+NaOH(aq)=H2O(1)+CH3COONa(aq)ΔH>-57.3kJ?mol-1 組卷:11引用:1難度:0.9
二、非選擇題:共56分。
-
19.“綠水青山就是金山銀山”,研究并消除氮氧化物污染對建設美麗家鄉(xiāng),打造宜居環(huán)境有重要意義。
(1)目前可利用以下化學原理解決汽車尾氣:2NO(g)+2CO(g)?2CO2(g)+N2(g)。一定條件下,在容積固定的容器中進行上述反應,CO濃度c(CO)與時間關系如圖所示: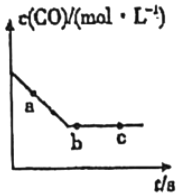
①a、b、c三點的正反應速率明v(a)、v(b)、v(c)的大小關系是。
②下列可說明反應到達圖中c點的是。
A.NO、CO、CO2、N2的濃度比值保持2:2:2:1不變
B.CO的濃度不再改變
C.反應消耗2molNO的同時消耗1molN2
D.容器中氣體質量不發(fā)生變化
(2)用活性炭還原法處理氮氧化物的有關反應為:2NO(g)+C(s)?CO2(g)+N2(g)。向某密閉容器中加入一定量的活性炭和,其反應速率與時間的關系如圖所示,在t1時刻某條件發(fā)生改變。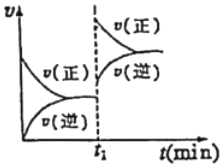
①由圖可判斷該反應為(填“吸熱”或“放熱”)反應。
②一定溫度下,隨著NO的起始濃度增大,則NO的平衡轉化率(填“增大”、“不變”或“減小”)。
(3)影響化學反應速率的因素有很多,某課外興趣小組用實驗的方法對其進行探究。取3mol/L的H2O2溶液各10mL分別進行下列實驗,實驗報告如表所示。
①實驗1、2研究的是序號 V(過氧化氫溶液)/mL V(氯化鐵溶液)/mL 二氧化錳質量/g 反應溫度/℃ V(水)/mL 結論 1 10 2 0 50 8 2 10 2 0 30 8 3 10 0 1 30 a 對H2O2分解速率的影響。
②表中數(shù)據(jù)a的值應該為;實驗2、3研究的是對H2O2分解速率的影響。組卷:14引用:1難度:0.6 -
20.用X(g)和Y(g)合成Z(g)在三種不同實驗條件下,在密閉容器中進行反應X(g)+2Y(g)?Z(g)ΔH<0。已知起始濃度:c(X)=0.100mol?L-1,c(Y)=0.200mol?L-1。X(g)的濃度隨時間的變化如圖所示。回答下列問題:
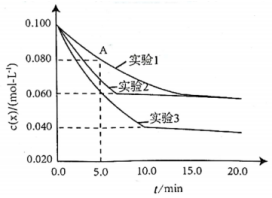
(1)實驗1,該反應進行到時,。
(2)與實驗1比較,實驗2所改變的條件是,判斷的理由是。
(3)甲同學認為,與實驗1比較,實驗3所改變的條件是提高反應溫度,乙同學認為該觀點是錯誤的,乙同學的理由是。
(4)實驗3中,Y(g)的平衡轉化率為,平衡常數(shù)K的代數(shù)式為:。
(5)CO和H2在一定條件下可以合成甲醇:CO(g)+2H2(g)=CH3OH(g)ΔH。在密閉容器中按物質的量之比為1:2充入CO和H2,測得平衡混合氣體中CO的平衡轉化率隨溫度.壓強的變化關系如圖所示。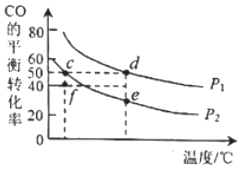
由圖可知p1p2(填“>”“<”);ΔH(填“>”“<”);組卷:1引用:1難度:0.6


