 電池是人類生產和生活中的重要能量來源,各式各樣電池的發明是化學對人類的一項重要貢獻。
電池是人類生產和生活中的重要能量來源,各式各樣電池的發明是化學對人類的一項重要貢獻。
(1)生活中利用原電池原理生產了各種各樣的電池,下列有關電池的敘述正確的是 BB(填字母)。
A.鋅錳電池工作一段時間后碳棒會變細
B.氫氧燃料電池可將化學能直接轉變為電能
C.鉛蓄電池負極是PbO2,正極是Pb
(2)氫氧燃料電池有酸式和堿式兩種,它們放電時的電池總反應式都可表示為:2H2+O2=2H2O。
①酸式氫氧燃料電池的電解質是酸,其正極的電極反應式為 O2+4e-+4H+=2H2OO2+4e-+4H+=2H2O。
②工作一段時間后,電解質溶液的pH將 變大變大(填“變大”、“變小”或“不變”)。
(3)將CH4設計成燃料電池,其利用率更高,裝置如圖所示(A、B為多孔碳棒),電池總反應為:CH4+2O2+2KOH=K2CO3+3H2O。
實驗測得電子定向移向A電極,則 BB(填“A”或“B”)電極入口通甲烷,其電極反應式為 CH4-8e-+10OH-=CO2-3+7H2OCH4-8e-+10OH-=CO2-3+7H2O。
(4)某同學欲把反應Fe+2FeCl3=3FeCl2設計成原電池,請寫出負極的電極反應式:Fe-2e-=Fe2+Fe-2e-=Fe2+。
CO
2
-
3
CO
2
-
3
【答案】B;O2+4e-+4H+=2H2O;變大;B;CH4-8e-+10OH-=+7H2O;Fe-2e-=Fe2+
CO
2
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:76引用:3難度:0.5
相似題
-
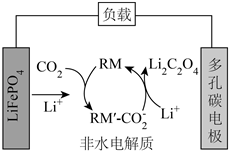 1.我國某科研團隊借助氧化還原介質RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說法正確的是( )
1.我國某科研團隊借助氧化還原介質RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說法正確的是( )A.LiFePO4電極的電勢比多孔碳電極的高 B.負極反應:LiFePO4-xe-═Li(1-x)FePO4+xLi+ C.RM和RM′- 均為該電池反應的催化劑CO-2D.LiFePO4電極每減重7g,就有22gCO2被固定 發布:2024/12/20 4:30:1組卷:156引用:2難度:0.5 -
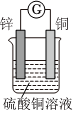 2.如圖所示將鋅、銅通過導線相連,置于硫酸銅溶液中。
2.如圖所示將鋅、銅通過導線相連,置于硫酸銅溶液中。
(1)該裝置將轉化為能。
(2)Zn電極為極,發生反應,電極方程式為。
(3)外電路電子由電極經導線流向電極。
(4)若反應過程中鋅溶解了6.5g,則銅電極增重g,該回路中轉移的電子數為。發布:2024/12/30 3:0:4組卷:315引用:2難度:0.7 -
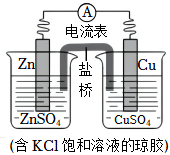 3.銅鋅原電池的裝置如圖,其中鹽橋為內含KCl的瓊脂凝膠,下列說法不正確的是( )
3.銅鋅原電池的裝置如圖,其中鹽橋為內含KCl的瓊脂凝膠,下列說法不正確的是( )A.Zn是負極反應物,發生氧化反應 B.電子從鋅片流向銅片 C.銅電極上發生反應Cu2++2e-═Cu D.鹽橋中Cl-進入CuSO4溶液 發布:2024/12/15 19:30:1組卷:195引用:1難度:0.5


