Ⅰ.下表是某兒童在哈爾濱市醫(yī)療機(jī)構(gòu)臨床檢驗(yàn)結(jié)果報(bào)告單的部分?jǐn)?shù)據(jù):
| 分析項(xiàng)目 | 檢測(cè)結(jié)果 | 單位 | 參考范圍 | |
| 1 | 鋅(Zn) | 115.92 | mol?L-1 | 66-120 |
| 2 | 鐵(Fe) | 6.95 | mmol?L-1 | 7.52-11.82 |
| 3 | 鈣(Ca) | 1.78 | mmol?L-1 | 1.55-2.10 |
(1)該兒童
鐵
鐵
元素含量偏低(填元素名稱)。(2)報(bào)告單中“mol?L-1”是
濃度
濃度
(填“質(zhì)量”、“體積”或“濃度”)的單位。(3)檢測(cè)兒童的血液中鈣的含量,參考指標(biāo)常以兩種計(jì)量單位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示時(shí),鈣的正常含量參考范圍是1.55~2.10mmol/L。如果以“mg/dL”表示,鈣的正常含量參考范圍是
6.2~8.4
6.2~8.4
mg/dL。Ⅱ.驗(yàn)證氧化性Cl2>Fe3+>SO2,某小組用如圖所示裝置進(jìn)行實(shí)驗(yàn)(夾持儀器和A中加熱裝置已省略,氣密性已檢驗(yàn))。
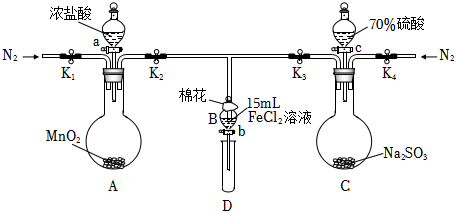
實(shí)驗(yàn)過程:
①打開止水夾K1~K4,通入一段時(shí)間N2,再將T型導(dǎo)管插入B中,繼續(xù)通入N2,然后關(guān)閉K1,K3,K4。
②打開活塞a,滴加一定量的濃鹽酸,給A加熱。
③當(dāng)B中溶液變黃時(shí),停止加熱,關(guān)閉K2。
④打開活塞b,使約2mL的溶液流入D試管中,檢驗(yàn)其中的離子。
⑤打開K3和活塞c,加入70%的硫酸溶液,一段時(shí)間后關(guān)閉K3。
⑥更換試管D,重復(fù)過程④,檢驗(yàn)B中溶液d離子。
(4)過程①的目的是
排凈裝置中的空氣
排凈裝置中的空氣
。(5)實(shí)驗(yàn)室在保存FeCl2溶液時(shí)為了防止FeCl2溶液變質(zhì),經(jīng)常向其中加入鐵粉的原因是
鐵和鐵離子反應(yīng)生成亞鐵離子,可以防止亞鐵離子被氧化
鐵和鐵離子反應(yīng)生成亞鐵離子,可以防止亞鐵離子被氧化
;綠色氧化劑H2O2氧化FeCl2溶液反應(yīng)的離子方程式為 2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
。(6)若向過程③B中的黃色溶液中通入H2S氣體,會(huì)觀察到有淡黃色沉淀生成,寫出該反應(yīng)的離子方程式:
2Fe3++H2S=2Fe2++2H++S↓
2Fe3++H2S=2Fe2++2H++S↓
。(7)若將C中制取的SO2通入硫酸酸化的高錳酸鉀溶液可使溶液褪色,其反應(yīng)的離子方程式為
5SO2+2+2H2O=2Mn2++5+4H+
M
n
O
-
4
SO
2
-
4
5SO2+2+2H2O=2Mn2++5+4H+
。M
n
O
-
4
SO
2
-
4
(8)甲、乙、丙三位同學(xué)分別完成了上述實(shí)驗(yàn),結(jié)論如下表所示。他們的檢測(cè)結(jié)果一定能夠證明氧化性Cl2>Fe3+>SO2的是
甲乙
甲乙
(填“甲”“乙”或“丙”)。| 過程④,B溶液中含有的離子 | 過程⑥,B溶液中含有的離子 | |
| 甲 | 有Fe3+無Fe2+ | 有Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有 SO 2 - 4 |
| 丙 | 有Fe3+無Fe2+ | 有 SO 2 - 4 |
【考點(diǎn)】氧化性、還原性強(qiáng)弱的比較;微量元素對(duì)人體健康的重要作用;物質(zhì)的量濃度的相關(guān)計(jì)算;鐵鹽和亞鐵鹽的相互轉(zhuǎn)化;二氧化硫的性質(zhì).
【答案】鐵;濃度;6.2~8.4;排凈裝置中的空氣;鐵和鐵離子反應(yīng)生成亞鐵離子,可以防止亞鐵離子被氧化;2Fe2++H2O2+2H+=2Fe3++2H2O;2Fe3++H2S=2Fe2++2H++S↓;5SO2+2+2H2O=2Mn2++5+4H+;甲乙
M
n
O
-
4
SO
2
-
4
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:84引用:1難度:0.7
相似題
-
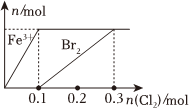 1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說法錯(cuò)誤的是( )
1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說法錯(cuò)誤的是( )A.還原性強(qiáng)弱:Fe2+>Br- B.由圖可知,該FeBr2溶液的濃度為1mol?L-1 C.n(Cl2)=0.12mol時(shí),溶液中的離子濃度有 ═c(Fe3+)c(Br-)59D.氯氣過量時(shí),反應(yīng)的離子方程式為:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- 發(fā)布:2024/12/7 9:30:1組卷:50引用:3難度:0.5 -
2.根據(jù)反應(yīng)式:①2Fe3++2I-═2Fe2++I2,②Br2+2Fe2+═2Br-+2Fe3+,可判斷離子的還原性從強(qiáng)到弱的順序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 發(fā)布:2024/11/28 12:30:2組卷:346引用:8難度:0.8 -
3.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2。
則下列判斷正確的是( )A.氧化性:MnO4->Fe3+>Cl2>I2 B.還原性:Cl->I->Fe2+ C.Fe3+只有氧化性,F(xiàn)e2+只有還原性 D.由信息推測(cè):Cl2+2I-═2Cl-+I2反應(yīng)可以進(jìn)行 發(fā)布:2024/12/11 14:0:2組卷:421引用:7難度:0.4
相關(guān)試卷


