物質(zhì)在水溶液中可能存在電離平衡、鹽的水解平衡或沉淀溶解平衡,它們都可看作化學(xué)平衡的一種,請根據(jù)所學(xué)化學(xué)知識回答下列問題:
(1)已知CH3COONH4溶液呈中性。常溫下,濃度均為0.1mol/L的8種溶液:①HNO3溶液;②CH3COOH溶液;③Ba(OH)2溶液:④NaOH;⑤CH3COONH4溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧NH4Cl溶液。這些溶液中水的電離程度由大到小的順序是 ⑤>⑥=⑧>⑦>②>①=④>③⑤>⑥=⑧>⑦>②>①=④>③(填序號)。
(2)25℃時,向0.1mol/L的氯化銨溶液中加入0.1mol/L的氨水,判斷銨離子的水解程度如何變化并說明理由:變小,NH+4+H2O?NH3?H2O+H+,加入氨水增大了c(NH3?H2O),抑制了銨離子的水解變小,NH+4+H2O?NH3?H2O+H+,加入氨水增大了c(NH3?H2O),抑制了銨離子的水解。
(3)室溫下,如果將0.2molNH4Cl和0.1molNaOH全部溶于水,形成混合溶液(假設(shè)無損失),寫出電荷守恒表達式(用濃度表示) c(NH+4)+c(H+)+c(Na+)=c(Cl-)+c(OH-)c(NH+4)+c(H+)+c(Na+)=c(Cl-)+c(OH-)。
(4)如圖所示,橫坐標為溶液的pH,縱坐標為Zn2+或[Zn(OH)4]2-物質(zhì)的量濃度的對數(shù)。回答下列問題:
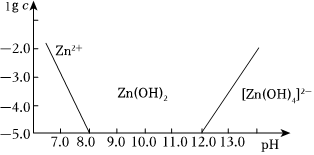
從圖中數(shù)據(jù)計算可得Zn(OH)2的溶度積(Ksp)=1.0×10-171.0×10-17。
(5)在25℃下,將a mol?L-1的氨水與0.01mol?L-1的鹽酸等體積混合,反應(yīng)平衡時溶液中c(NH+4)=c(Cl-),則溶液顯 中中性(填“酸”“堿”或“中”);用含a的代數(shù)式表示NH3?H2O的電離常數(shù)Kb=10-9a-0.0110-9a-0.01。
NH
+
4
NH
+
4
NH
+
4
NH
+
4
NH
+
4
1
0
-
9
a
-
0
.
01
1
0
-
9
a
-
0
.
01
【考點】鹽類水解的原理.
【答案】⑤>⑥=⑧>⑦>②>①=④>③;變小,+H2O?NH3?H2O+H+,加入氨水增大了c(NH3?H2O),抑制了銨離子的水解;c()+c(H+)+c(Na+)=c(Cl-)+c(OH-);1.0×10-17;中;
NH
+
4
NH
+
4
1
0
-
9
a
-
0
.
01
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:44引用:1難度:0.7
相似題
-
1.Fe2(SO4)3溶于一定量水中,溶液呈淺棕黃色(a)。加入少量濃HCl黃色加深(b)。
已知:Fe3++4Cl-?[FeCl4]-(黃色);濃度較小時[Fe(H2O)6]3+(用Fe3+表示)幾乎無色
取溶液進行如下實驗,對現(xiàn)象的分析不正確的是( )A.測溶液a的pH≈1.3,證明Fe3+發(fā)生了水解 B.加入濃HCl,H+與Cl-對溶液顏色變化、Fe3+濃度大小的影響是一致的 C.向b中加入AgNO3后,黃色褪去,說明H+能抑制Fe3+水解 D.將溶液a滴入沸水中,加熱,檢測有丁達爾效應(yīng),說明加熱能促進Fe3+水解 發(fā)布:2024/12/30 3:30:1組卷:190引用:6難度:0.7 -
2.硫酸是常見三大強酸之一,中學(xué)階段我們將硫酸在水溶液中看作完全電離。但事實是硫酸在水中的第一步電離是完全的,第二步電離并不完全,其電離方程式為:H2SO4=H++HSO4-,HSO4-?H++SO42-.請依據(jù)以上事實回答下列有關(guān)問題:
(1)Na2SO4溶液呈(填“弱酸性”、“中性”或“弱堿性”),其理由是(用離子方程式表示);
(2)常溫下將 NaHSO4溶液進行稀釋,下列說法正確的是(填序號)
A.溶液中導(dǎo)電粒子的數(shù)目減少
B.溶液中離子的濃度均減小
C.溶液中不變[OH-]?[HSO-4][SO2-4]
D.溶液中由水電離產(chǎn)生的[H+]增大
(3)H2SO4溶液與Ba(OH)2溶液反應(yīng)的離子方程式為:。
(4)在0.10mol?L-1的Na2SO4溶液中,下列離子濃度關(guān)系正確的是(填寫編號);
A.[SO42-]+[HSO4-]+[H2SO4]=0.1 mol?L-1
B.[OH-]=[H+]+[HSO4 -]
C.[Na+]+[H+]=[OH-]+[HSO4-]+2[SO42-]
D.[Na+]>[SO42-]>[OH-]>[H2SO4-]>[H+]
(5)用0.100mol?L-1的氫氧化鈉溶液滴定一定體積未知濃度的稀硫酸,用做指示劑誤差較小,到達滴定終點的判斷方法是,滴定后發(fā)現(xiàn)堿式滴定管尖嘴部分有氣泡,測定結(jié)果會(填“偏大”“偏小”或“無影響”)。發(fā)布:2024/11/8 8:0:1組卷:92引用:1難度:0.6 -
3.下列物質(zhì)因發(fā)生水解反應(yīng)而使溶液呈酸性的是( )
A.HNO3 B.CuCl2 C.K2CO3 D.CH3COOH 發(fā)布:2024/12/4 22:30:1組卷:135引用:2難度:0.8
相關(guān)試卷


