氮及其化合物在生產(chǎn)生活中有著廣泛的應(yīng)用,但同時隨意排放氮的化合物也會造成環(huán)境污染問題。
Ⅰ.某研究性學(xué)習(xí)小組設(shè)計用如圖所示實驗裝置(夾持儀器省略)制取干燥的氨氣并驗證NH3具有還原性,請回答下列問題:

(1)實驗室制備氨氣有多種方法,現(xiàn)欲用NH4Cl與熟石灰反應(yīng)制取NH3,則該反應(yīng)的化學(xué)方程式為 2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O。
(2)實驗進行一段時間后,觀察到加熱的硬質(zhì)玻璃管內(nèi)黑色氧化銅粉末變?yōu)榧t色,盛無水CuSO4的干燥管內(nèi)出現(xiàn)藍色,并且在最后的出氣導(dǎo)管處收集到純凈、干燥的N2。則該反應(yīng)的化學(xué)方程式為 3CuO+2NH3 △ 3Cu+3H2O+N23CuO+2NH3 △ 3Cu+3H2O+N2。
Ⅱ.氨是工業(yè)生產(chǎn)硝酸的重要原料,請根據(jù)以下工業(yè)制硝酸的原理示意圖回答含氮化合物相關(guān)的問題:

(1)氨氣在“氧化爐”中被催化氧化為NO。
(2)為避免硝酸生產(chǎn)尾氣中的氮氧化物污染環(huán)境,人們開發(fā)了溶液吸收、催化還原等尾氣處理方法。前者使用具有堿性的純堿溶液等吸收尾氣,后者使用NH3將氨氧化物還原為N2。
①純堿溶液吸收法。請以尾氣中NO2處理為例,寫出該反應(yīng)的離子方程式 2NO2+CO2-3=NO-3+NO-2+CO22NO2+CO2-3=NO-3+NO-2+CO2。
②氨轉(zhuǎn)化法。已知6mol氨恰好能將含NO和NO2共6mol的混合氣體完全轉(zhuǎn)化為N2,則混合氣體中NO和NO2的物質(zhì)的量之比為 1:11:1。
Ⅲ.國家規(guī)定地下水中氮氧化物的排放標準不超過400mg?L-1,NO2可以用酸性硫酸亞鐵溶液來吸收,反應(yīng)原理為NO2+3Fe2++2H+═2Fe3++Fe(NO)2++H2O。現(xiàn)測定某地下水脫硝過程中NO2的排放量:收集500.00mL排放的氣體,緩慢通過250.00mL0.6240mol?L-1酸性FeSO4溶液(過量),充分反應(yīng),量取吸收氣體后的溶液25.00mL置于錐形瓶中,用0.2000mol?L-1酸性KMnO4溶液反應(yīng)過量的Fe2+(還原產(chǎn)物為Mn2+),消耗酸性KMnO4溶液的體積為15.00mL。試通過計算分析地下水脫硝過程中氮氧化物的排放是否符合國家標準?符合符合(寫出計算過程)。
△
△
△
△
CO
2
-
3
NO
-
3
NO
-
2
CO
2
-
3
NO
-
3
NO
-
2
【考點】氨的實驗室制法.
【答案】2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;3CuO+2NH3 3Cu+3H2O+N2;2NO2+=++CO2;1:1;符合
△
△
CO
2
-
3
NO
-
3
NO
-
2
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:80引用:1難度:0.6
相似題
-
1.甲、乙、丙三位同學(xué)分別用圖1所示實驗裝置制取氨氣.請你根據(jù)實驗探究的過程,回答下列有關(guān)問題.
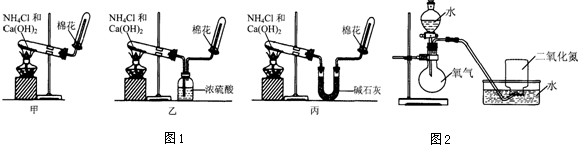
(1)三位同學(xué)制取氨氣的化學(xué)方程式是.
(2)三位同學(xué)用上述裝置制取氨氣時,其中有一位同學(xué)沒有收集到氨氣(實驗操作都正確),你認為沒有收集到氨氣的同學(xué)是(填圖1中“甲”、“乙”或“丙”).
(3)為確定試管內(nèi)是否已收集滿氨氣,應(yīng)將置于收集氣體的試管口處,若觀察到,則說明氨氣已收集滿.
(4)三位同學(xué)都認為他們的實驗裝置還可用于加熱碳酸氫銨固體來制取純凈的氨氣,你判斷能夠達到實驗?zāi)康耐瑢W(xué)是(填圖1中“甲”、“乙”或“丙”).
(5)氨氣是一種重要的化工產(chǎn)品,氨氣經(jīng)一系列反應(yīng)可制得硝酸,其中關(guān)鍵步驟之一是將二氧化氮溶于水生成硝酸.為使二氧化氮盡可能全部被水吸收,且殘留的氣體盡可能少,某同學(xué)設(shè)計了如圖2所示的實驗裝置,進行了如下實驗探究過程.請回答有關(guān)問題.實驗過程 實驗現(xiàn)象 步驟一 將收集滿NO2的集氣瓶倒立在水槽中. 集氣瓶中液面上升;集氣瓶中氣體由紅棕色變成無色;最終剩余氣體約占集氣瓶體積的 .步驟二 將分液漏斗中的水逐滴滴入燒瓶,使少量O2進入盛有NO2的集氣瓶后,停止滴水. 集氣瓶中氣體顏色的變化情況是 ;集氣瓶中液面繼續(xù)上升.步驟三 多次重復(fù)步驟二操作,并依次減少O2通入量,直至O2通入后,氣體不再變成 色.現(xiàn)象與步驟二相同,最后集氣瓶內(nèi)幾乎充滿液體,只含極少量氣體. 計算 用上述實驗方法,將標準狀況下448mLNO2全部溶于水,得到500mL溶液,則溶液中HNO3的物質(zhì)的量濃度為 .發(fā)布:2024/12/30 5:0:1組卷:64引用:3難度:0.3 -
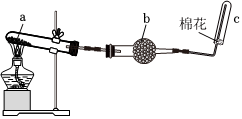 2.某化學(xué)研究小組的同學(xué)在實驗室中利用如圖裝置制取并收集少量干燥NH3。下列敘述正確的是( )
2.某化學(xué)研究小組的同學(xué)在實驗室中利用如圖裝置制取并收集少量干燥NH3。下列敘述正確的是( )A.試管a中的固體是NH4Cl和NaOH的混合物 B.裝置b中的試劑是堿石灰 C.用塞子代替棉花,收集到的NH3純度更高 D.用蘸有濃硫酸的玻璃棒靠近c試管口能檢驗NH3是否收集滿 發(fā)布:2024/12/30 7:30:1組卷:129引用:2難度:0.8 -
3.實驗室制取少量干燥的氨氣涉及下列裝置,其中正確的是( )
A. 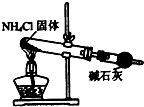
氨氣發(fā)生裝置B. 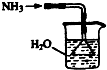
氨氣吸收裝置C. 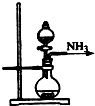
氨氣發(fā)生裝置D. 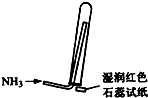
氨氣收集、檢驗裝置發(fā)布:2024/12/30 5:30:2組卷:36引用:6難度:0.9


