鐵元素的納米材料因具備良好的電學特性和磁學特性,而引起了廣泛的研究。納米零價鐵可用于去除水體中的六價鉻[Cr(Ⅵ)]與硝酸鹽等污染物。
(1)①用FeCl2溶液與NaBH4(H元素為-1價)溶液反應制備納米零價鐵的化學方程式:FeCl2+2NaBH4+6H2O=Fe+2B(OH)3+2NaCl+7H2↑。當生成1molFe時,反應中轉移電子的物質的量為 8mol8mol。
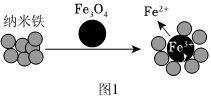
②納米Fe和Fe3O4均可用于降解含Cr2O2-7的廢水。實驗證明Fe3O4輔助納米鐵去除Cr2O2-7效果更佳,結合圖1,分析其原因是 Fe3O4有磁性,吸引納米鐵,使其分散附著在Fe3O4表面,增大表面積;納米鐵能將含Fe3+物質還原為Fe2+,濃度增大,降解速率加快Fe3O4有磁性,吸引納米鐵,使其分散附著在Fe3O4表面,增大表面積;納米鐵能將含Fe3+物質還原為Fe2+,濃度增大,降解速率加快。
(2)納米鐵碳微電技術是一種利用鐵和碳的原電池反應去除水中污染物的技術達到無害排放,該技術處理酸性廢水中NO-2時正極電極反應式為 8H++2NO-2+6e-=N2↑+4H2O8H++2NO-2+6e-=N2↑+4H2O。
(3)利用納米鐵粉去除水體中的Cr(Ⅵ)反應機理如圖2所示。
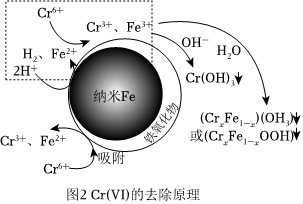
①該反應機理中虛線部分可描述為 H+被吸附到納米鐵表面得電子生成H2同時生成Fe2+;Fe2+還原Cr6+生成Cr3+和Fe3+H+被吸附到納米鐵表面得電子生成H2同時生成Fe2+;Fe2+還原Cr6+生成Cr3+和Fe3+。
②為了考察溶解氧對水體中的Cr(Ⅵ)去除率的影響,實驗小組設計了一組對比實驗,其中一組在反應中通入N2,另一組不通入N2。結果表明,實驗初期,通入N2的去除率遠高于未通N2的,其原因可能是 有氧條件下,鐵粉表面生成的氧化物在反應過程中起了一定阻礙作用有氧條件下,鐵粉表面生成的氧化物在反應過程中起了一定阻礙作用。
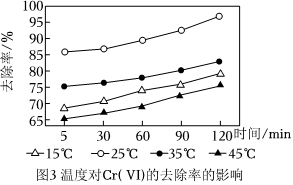
③某水樣Cr(Ⅵ)的初始濃度為10mg/L,在相同條件下,探討了溫度為15℃、25℃、35℃、45℃對Cr(Ⅵ)的去除率的影響,結果如圖3所示,由圖可知,溫度在25℃時,去除率最高,其原因是 低于25℃時,溫度升高,對鐵氧化物層的腐蝕起到了促進作用,加快反應速率;高于25℃時,溫度升高不利于發生吸附反應,導致去除率下降低于25℃時,溫度升高,對鐵氧化物層的腐蝕起到了促進作用,加快反應速率;高于25℃時,溫度升高不利于發生吸附反應,導致去除率下降。
O
2
-
7
O
2
-
7
NO
-
2
8
H
+
+
2
N
O
-
2
+
6
e
-
=
N
2
↑
+
4
H
2
O
8
H
+
+
2
N
O
-
2
+
6
e
-
=
N
2
↑
+
4
H
2
O
【答案】8mol;Fe3O4有磁性,吸引納米鐵,使其分散附著在Fe3O4表面,增大表面積;納米鐵能將含Fe3+物質還原為Fe2+,濃度增大,降解速率加快;;H+被吸附到納米鐵表面得電子生成H2同時生成Fe2+;Fe2+還原Cr6+生成Cr3+和Fe3+;有氧條件下,鐵粉表面生成的氧化物在反應過程中起了一定阻礙作用;低于25℃時,溫度升高,對鐵氧化物層的腐蝕起到了促進作用,加快反應速率;高于25℃時,溫度升高不利于發生吸附反應,導致去除率下降
8
H
+
+
2
N
O
-
2
+
6
e
-
=
N
2
↑
+
4
H
2
O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:83引用:3難度:0.5
相似題
-
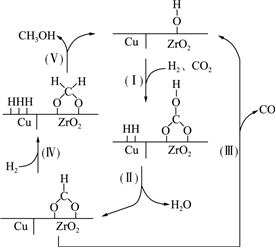 1.氫氣和二氧化碳在催化劑作用下合成甲醇的反應為放熱反應,催化過程可解釋為“吸附-活化-解離”的過程,催化反應機理如圖所示。下列說法正確的是( )
1.氫氣和二氧化碳在催化劑作用下合成甲醇的反應為放熱反應,催化過程可解釋為“吸附-活化-解離”的過程,催化反應機理如圖所示。下列說法正確的是( )A.反應過程中Ⅰ~Ⅴ步,C元素化合價不變 B.單位時間內生成的水越多,則甲醇的產率越大 C.增大催化劑的表面積,可以提高甲醇的平衡產率 D.氫氣和二氧化碳在催化反應過程中有副產物CO生成 發布:2024/11/17 18:0:2組卷:14引用:4難度:0.8 -
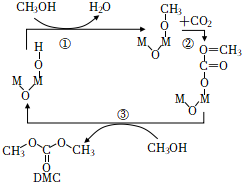 2.碳酸二甲酯(DMC)具有優良的化學反應性能。在眾多研究方向中,CO2和甲醇直接合成 DMC 的方法受到了較多的關注,M2O(OH)催化該反應的一種反應機理如圖所示。下列敘述正確的是( )
2.碳酸二甲酯(DMC)具有優良的化學反應性能。在眾多研究方向中,CO2和甲醇直接合成 DMC 的方法受到了較多的關注,M2O(OH)催化該反應的一種反應機理如圖所示。下列敘述正確的是( )A.M2O(OH)是反應的催化劑,H2O是反應中間體 B.DMC中共面的原子數最多為6個 C.DMC的同分異構體中同時含有羧基和羥基的物質有2種(不考慮立體異構) D.反應①②③均為取代反應 發布:2024/12/30 3:30:1組卷:18引用:2難度:0.6 -
3.CO2捕獲和轉化可減少CO2排放并實現資源利用,原理如圖1所示。反應①完成之后,以N2為載氣,以恒定組成的N2、CH4混合氣,以恒定流速通入反應器,單位時間流出氣體各組分的物質的量隨反應時間變化如圖2所示。反應過程中始終未檢測到CO2,在催化劑上有積碳。下列說法不正確的是( )
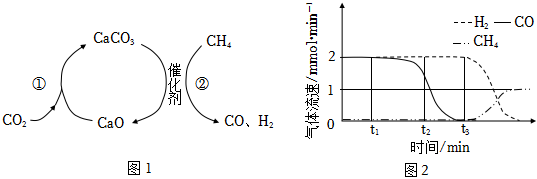
A.反應①為CaO+CO2=CaCO3;反應②為CaCO3+CH4 CaO+2CO+2H2催化劑B.t1~t3,n(H2)比n(CO)多,且生成H2速率不變,可能有副反應CH4 C+2H2催化劑C.t2時刻,副反應生成H2的速率大于反應②生成H2速率 D.t3之后,生成CO的速率為0,是因為反應②不再發生 發布:2024/12/5 13:30:2組卷:101引用:9難度:0.5


