2023年江蘇省新高考基地學校高考化學聯考試卷(3月份)
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括13小題,每小題3分,共計39分。每小題只有一個選項符合題意。
-
1.生活與化學密不可分。下列生活用品中主要由合成纖維制造的是( )
A.尼龍繩 B.銅導線 C.蠶絲被 D.棉襯衫 組卷:18引用:2難度:0.7 -
2.乙醛常用于有機合成,由乙醇催化氧化制取乙醛的反應如下:2CH3CH2OH+O2
2CH3CHO+2H2O。下列說法正確的是( )Cu△A.相同條件下,CH3CH2OH的沸點高于CH3OCH3 B.基態Cu的核外電子排布式為[Ar]3d94s2 C.1molCH3CHO中所含σ鍵的數目為5mol D.H2O是由極性鍵構成的非極性分子 組卷:33引用:2難度:0.7 -
3.下列有關物質的性質與用途具有對應關系的是( )
A.氧化鐵能與酸反應,可用作紅色顏料 B.次氯酸具有弱酸性,可用作漂白劑 C.銀氨溶液具有弱氧化性,可用于制銀鏡 D.晶體硅熔點高,可用作半導體材料 組卷:17引用:3難度:0.7 -
4.X、Y、Z、W、R屬于周期表中前20號主族元素,且原子序數依次增大。基態X原子2p軌道半充滿,Z是元素周期表中電負性最大的元素,Z和W同主族,R的最外層只有1個電子。下列說法正確的是( )
A.X的簡單氫化物分子間能形成氫鍵 B.簡單離子半徑:r(R)>r(W) C.簡單氣態氫化物的熱穩定性:W>Z D.第一電離能:I1(X)>I1(Y)>I1(Z) 組卷:47引用:3難度:0.7 -
5.閱讀下列資料,完成5~7題:
侯氏制堿法以氯化鈉、二氧化碳、氨和水為原料,發生反應NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。將析出的固體灼燒獲取純堿,向析出固體后的母液中加入食鹽可獲得副產品氯化銨。
下列制純堿的實驗原理與裝置不能達到實驗目的的是( )A. 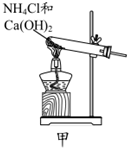
用裝置甲制取氨氣B. 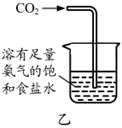
用裝置乙制取碳酸氫鈉C. 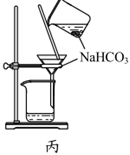
用裝置丙過濾得到碳酸氫鈉固體D. 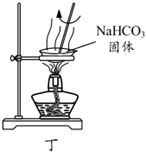
用裝置丁加熱分解碳酸氫鈉得到純堿組卷:20引用:0難度:0.50
二、解答題(共4小題,滿分61分)
-
16.氯化亞銅(CuCl)是重要的銅鹽系列產品,某學習小組用海綿銅制取氯化亞銅的流程如圖:
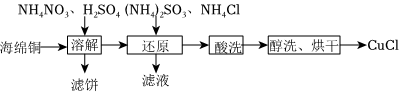
CuCl難溶于水和乙醇,易溶于Cl-濃度較大的體系(CuCl+Cl-?)。CuCl-2
Ⅰ.海綿銅的溶解
經觀察,海綿銅(主要成分是Cu和CuO)在“溶解”過程中未產生氣泡,反應原理為:
反應①:CuO+H2SO4=CuSO4+H2O(較快);
反應②:(較慢)
(1)寫出反應②的化學方程式。
(2)實驗過程中,測得不同溫度下浸出液中Cu2+的質量濃度如圖1所示。圖中顯示在第1h內銅的浸出率較大,其原因是。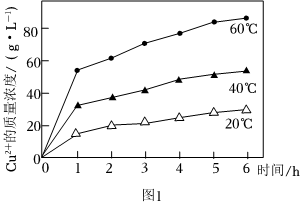
Ⅱ.氯化亞銅的制備
利用海綿銅“溶解”后的溶液與(NH4)2SO3、NH4Cl反應,可制備氯化亞銅,裝置如圖2所示。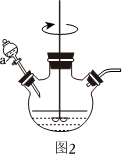
(3)“還原”過程中一般采用=0.6最為適宜,原因是n[(NH4)2SO3]n(Cu2+)。
(4)下表是氯化銨用量與Cu2+沉淀率的關系如下表所示,Cu2+沉淀率在比值為1.1時最大的原因是[n(NH4Cl)n(Cu2+)]。
(5)“酸洗”步驟中,最合適選用的試劑是n(NH4Cl)n(Cu2+)0.8 0.9 1.0 1.1 1.2 1.3 Cu2+沉淀率/% 35.3 73.2 85.2 91.3 79.2 65.4 (寫酸的名稱)。
Ⅲ.氯化亞銅的提純
(6)已知:水解可生成CuCl。溫度、pH對CuCl產率的影響如圖所示。CuCl2-3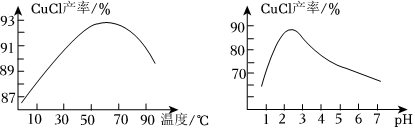
請根據以上信息,設計由CuCl、Cu和CuO的混合固體中提純CuCl的實驗方案:。(實驗中須使用的試劑與儀器:飽和NaCl溶液、0.1mol?L-1的H2SO4溶液、乙醇、真空干燥箱)組卷:82引用:3難度:0.6 -
17.鐵元素的納米材料因具備良好的電學特性和磁學特性,而引起了廣泛的研究。納米零價鐵可用于去除水體中的六價鉻[Cr(Ⅵ)]與硝酸鹽等污染物。
(1)①用FeCl2溶液與NaBH4(H元素為-1價)溶液反應制備納米零價鐵的化學方程式:FeCl2+2NaBH4+6H2O=Fe+2B(OH)3+2NaCl+7H2↑。當生成1molFe時,反應中轉移電子的物質的量為。
②納米Fe和Fe3O4均可用于降解含Cr2的廢水。實驗證明Fe3O4輔助納米鐵去除Cr2O2-7效果更佳,結合圖1,分析其原因是O2-7。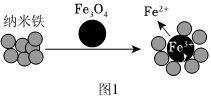
(2)納米鐵碳微電技術是一種利用鐵和碳的原電池反應去除水中污染物的技術達到無害排放,該技術處理酸性廢水中時正極電極反應式為NO-2。
(3)利用納米鐵粉去除水體中的Cr(Ⅵ)反應機理如圖2所示。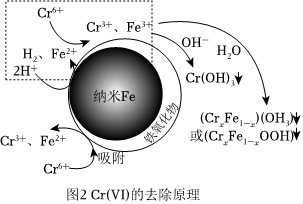
①該反應機理中虛線部分可描述為。
②為了考察溶解氧對水體中的Cr(Ⅵ)去除率的影響,實驗小組設計了一組對比實驗,其中一組在反應中通入N2,另一組不通入N2。結果表明,實驗初期,通入N2的去除率遠高于未通N2的,其原因可能是。
③某水樣Cr(Ⅵ)的初始濃度為10mg/L,在相同條件下,探討了溫度為15℃、25℃、35℃、45℃對Cr(Ⅵ)的去除率的影響,結果如圖3所示,由圖可知,溫度在25℃時,去除率最高,其原因是。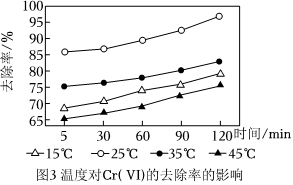 組卷:83引用:3難度:0.5
組卷:83引用:3難度:0.5


