(1)在宏觀、微觀、符號之間建立聯系,是化學學科特有的思維方式。
?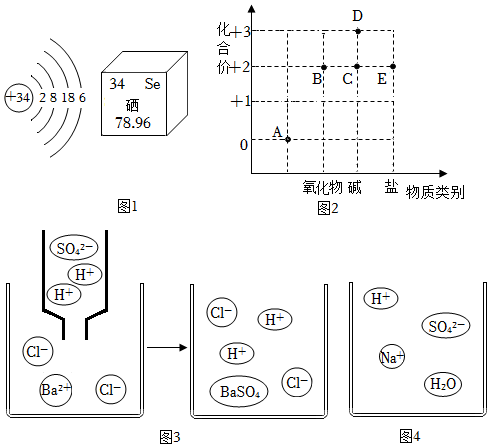
①圖1是硒元素在元素周期表中的相關信息和硒的原子結構示意圖。硒原子的相對原子質量為硒原子在化學反應中容易得到電子,形成的離子符號為 Se2-Se2-。
②以化合價為縱坐標,以物質的類別為橫坐標所繪制的圖像叫價類圖。如圖2為鐵的價類圖。寫出一個由C通過中和反應轉化為E的化學方程式 Fe(OH)2+2HCl=FeCl2+2H2OFe(OH)2+2HCl=FeCl2+2H2O。
③稀鹽酸不能與氯化鋇溶液反應,而稀硫酸則能與之反應生成白色沉淀,根據圖3從微觀角度分析實際參加反應的微粒是 Ba2+、SO2-4Ba2+、SO2-4(用符號表示)。
④通過分析組成和結構,可以預測物質的某些性質。根據圖4硫酸氫鈉溶液的微觀圖示,分析推測的性質,其中合理的是 BDBD。
A.硫酸氫鈉溶液中含有氫離子,所以硫酸氫鈉屬于酸
B.硫酸氫鈉溶液能與碳酸鈉反應
C.硫酸氫鈉溶液能與銅粉反應生成氫氣
D.硫酸氫鈉溶液能與硝酸鋇溶液反應生成硫酸鋇沉淀
(2)金屬材料在生活中被廣泛應用,回答下列問題。
①合金在生活中應用非常廣泛,下列關于合金敘述中正確的是 ②④②④(填序號)。
A.合金中至少含有兩種金屬;
B.合金一定是混合物;
C.合金中元素以化合物形式存在;
D.合金的硬度一般比組成它的純金屬更高,抗腐蝕性也更好;
E.焊錫焊接金屬利用了熔點高的特性。
②同學們在實驗室進行“探究金屬的性質”實驗。將鋅粉和鐵粉的混合物加入到盛有一定量硝酸銀溶液的燒杯中,充分反應后過濾,得到濾渣和濾液。將所得濾渣放入稀鹽酸中,有氣泡產生,則濾渣中一定含有 鐵和銀鐵和銀。
③某興趣小組探究Zn、Fe、Cu、Ag四種金屬的活動性,進行如圖中甲、乙、丙三個實驗。
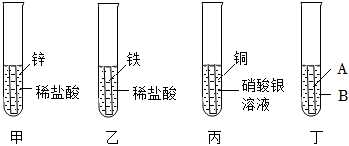 ?
?
A.甲、乙、丙三個實驗反應后溶液顏色各不相同,請寫出反應過程中溶液顏色變為淺綠色的化學反應方程式 Fe+2HCl═FeCl2+H2↑Fe+2HCl═FeCl2+H2↑。
B.小紅同學隨后發現該實驗無法得出四種金屬的活動性順序。于是又補充圖丁實驗,最終得出四種金屬活動性順序為:Zn>Fe>Cu>Ag,若A為金屬鐵,則試劑B為 硫酸銅硫酸銅溶液。
SO
2
-
4
SO
2
-
4
【答案】Se2-;Fe(OH)2+2HCl=FeCl2+2H2O;Ba2+、;BD;②④;鐵和銀;Fe+2HCl═FeCl2+H2↑;硫酸銅
SO
2
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 8:0:9組卷:67引用:1難度:0.3
相似題
-
1.在宏觀、微觀和符號之間建立聯系是化學學科的重要思維方式。

(1)如圖1是鎂原子和鍶原子結構示意圖。
①鎂和鍶兩種元素的最本質區別是。
②鍶與地殼中含量最多的元素形成的化合物為(填化學式)。
③元素的性質與其原子結構有密切關系。原子的最外層電子數相同時,電子層數越多,最外層電子離核越遠,原子核對最外層電子的吸引力越小。由此推測,鍶(Sr)的金屬的活動性比鎂(Mg)的金屬活動性(填“強”或“弱”)。
(2)氮及其化合物的“化合價-物質類別”關系圖如圖2。
①甲在空氣中的體積分數為;丙的化學式為HNO3,該物質的名稱是。
②若丁是工業用鹽NaNO2,能區別NaNO2溶液與食鹽溶液的一種試劑是。(友情提示:NaNO2有毒,有咸味,外形與食鹽相似,其水溶液呈堿性,AgNO2微溶于水。)
(3)圖3描述了NaOH與NaHSO4兩溶液反應的微觀示意圖。
①NaHSO4物質類別屬于(填“酸”、“堿”或“鹽”)。
②寫出與該反應微觀本質相同的另一化學方程式。發布:2024/12/24 9:0:1組卷:125引用:2難度:0.7 -
2.下列各組溶液,相互能發生反應的是( )
A.碳酸鉀和硝酸鋇 B.硝酸鋇和鹽酸 C.氫氧化鈉和碳酸鉀 D.硫酸鈉和碳酸鉀 發布:2024/12/25 16:0:1組卷:119引用:7難度:0.9 -
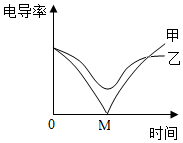 3.電導率傳感器可輔助探究復分解反應的實質,相同條件下,離子濃度越大,電導率越大,溶液導電性越強.將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個燒杯中并插入電導率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測得溶液的電導率變化如圖所示.下列說法正確的是( )
3.電導率傳感器可輔助探究復分解反應的實質,相同條件下,離子濃度越大,電導率越大,溶液導電性越強.將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個燒杯中并插入電導率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測得溶液的電導率變化如圖所示.下列說法正確的是( )A.甲曲線對應的是氫氧化鋇與硫酸鈉反應 B.甲曲線上的M點代表兩種溶液恰好完全反應 C.乙曲線電導率減小過程中,溶液由紅色變為無色 D.乙曲線對應的反應中四種離子數目都減少 發布:2024/12/25 11:0:2組卷:176引用:4難度:0.5


