 為研究HA、HB溶液和MOH的酸堿性的相對強弱,某化學(xué)學(xué)習(xí)小組設(shè)計了以下實驗:室溫下,將pH=2的兩種酸溶液HA、HB和pH=12的堿溶液MOH各1mL,分別加水稀釋到1000mL,其pH的變化與溶液體積的關(guān)系如圖所示,根據(jù)所給數(shù)據(jù),請回答下列問題:
為研究HA、HB溶液和MOH的酸堿性的相對強弱,某化學(xué)學(xué)習(xí)小組設(shè)計了以下實驗:室溫下,將pH=2的兩種酸溶液HA、HB和pH=12的堿溶液MOH各1mL,分別加水稀釋到1000mL,其pH的變化與溶液體積的關(guān)系如圖所示,根據(jù)所給數(shù)據(jù),請回答下列問題:
(1)HA為強強酸,HB為弱弱酸(填“強”或“弱”).
(2)若c=9:則
①稀釋前HB溶液和MOH溶液等體積混合后,溶液中c(B-)>>c(M+) (填“>”或“<”或“=”).
②稀釋后的三種溶液中,由水電離的氫離子的濃度的大小順序為HA=MOH>HBHA=MOH>HB (用酸、堿的化學(xué)式表示).
③將稀釋后的HA溶液和MOH溶液取等體積混合,則所得溶液中c(A-)與c(M+)的大小關(guān)系為等于等于(填“大于”“小于”或“等于”).
(3)若b+c=14,則MOH為弱弱堿(填“強”或“弱”).將稀釋后的HB溶液和MOH溶液取等體積混合,所得混合溶液的pH等于等于7(填“大于”“小于”或“等于”).
【考點】比較強弱電解質(zhì)的實驗.
【答案】強;弱;>;HA=MOH>HB;等于;弱;等于
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:243引用:3難度:0.5
相似題
-
1.甲、乙兩位同學(xué)設(shè)計用實驗確定某酸HA是弱電解質(zhì),存在電離平衡,且改變條件平衡發(fā)生移動.實驗方案如下:
甲:①準確配制0.1mol?L-1的HA、HCl溶液各100mL;
②取純度相同,質(zhì)量、大小相等的鋅粒于兩支試管中,同時加入0.1mol?L-1的HA、HCl溶液各10mL,
按圖1裝好,觀察現(xiàn)象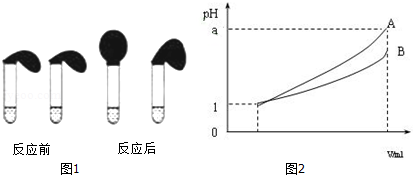
乙:①用pH計測定物質(zhì)的量濃度均為0.1mol?L-1HA和HCl溶液的pH;
②再取0.1mol?L-1的HA和HCl溶液各2滴(1滴約為1/20mL)分別稀釋至100mL,再用pH計測其pH變化
(1)甲、乙兩方案中都要用到mL的容量瓶.乙方案中說明HA是弱電解質(zhì)的理由是,測得0.1mol?L-1的HA溶液的pH1(填“>”、“<”或“=”);甲方案中,說明HA是弱電解質(zhì)的實驗現(xiàn)象是:.
A.加入HCl溶液后,試管上方的氣球鼓起慢
B.加入HA溶液后,試管上方的氣球鼓起慢
C.加入兩種稀酸后,兩個試管上方的氣球同時鼓起,且一樣大
(2)乙同學(xué)設(shè)計的實驗第步,能證明改變條件弱電解質(zhì)平衡發(fā)生移動.甲同學(xué)為了進一步證明弱電解質(zhì)電離平衡移動的情況,設(shè)計如下實驗:①使HA的電離程度和c(H+)都減小,c(A-)增大,可在0.1mol?L-1的HA溶液中,選擇加入試劑;
A.NaA固體(可完全溶于水) B.1mol?L-1NaOH溶液 C.1mol?L-1H2SO4 D.2mol?L-1HA
②使HA的電離程度減小,c(H+)和c(A-)都增大,可在0.1molL-1的HA溶液中,選擇加入試劑.
A.NaA固體(可完全溶于水) B.1mol?L-1NaOH溶液 C.1mol?L-1H2SO4 D.2mol?L-1HA
(3)pH=1的兩種酸溶液A、B各1mL,分別加水稀釋到1000mL,其pH與溶液體積V的關(guān)系如圖2所示,則下列說法不正確的有.
A.兩種酸溶液的物質(zhì)的量濃度一定相等
B.稀釋后,A酸溶液的酸性比B酸溶液弱
C.若a=4,則A是強酸,B是弱酸
D.若1<a<4,則A、B都是弱酸.發(fā)布:2024/6/27 10:35:59組卷:56引用:1難度:0.3 -
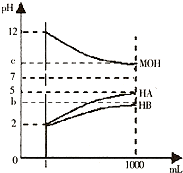 2.某化學(xué)學(xué)習(xí)小組為研究HA、HB和MOH的酸堿性的相對強弱,設(shè)計以下實驗以下實驗:將pH═2的兩種酸溶液HA,HB和pH=12的MOH堿溶液各1mL,分別加水稀釋到1000mL,其pH的變化與溶液體積的關(guān)系如圖,根據(jù)所給的數(shù)據(jù),請回答下列問題:
2.某化學(xué)學(xué)習(xí)小組為研究HA、HB和MOH的酸堿性的相對強弱,設(shè)計以下實驗以下實驗:將pH═2的兩種酸溶液HA,HB和pH=12的MOH堿溶液各1mL,分別加水稀釋到1000mL,其pH的變化與溶液體積的關(guān)系如圖,根據(jù)所給的數(shù)據(jù),請回答下列問題:
(1)HA為酸,HB為酸;(填“強”或“弱”)
(2)若c=9,則稀釋后的三種溶液中,由水電離的氫離子濃度的大小順序為(用酸、堿化學(xué)式表示);將稀釋后的HA溶液利MOH溶液取等體積混合,則所得溶液中c(A-)與c(M+)的大小關(guān)系為;(填“大于”、“小于“或“等于”)
(3)若b+c=14,則MQH為堿(填“強“或“弱”).將稀釋后的HB溶液和MOH溶液取等體積混合,所得很合溶液的pH7(填“大于”、“小于“或“等于”)發(fā)布:2024/6/27 10:35:59組卷:136引用:5難度:0.1 -
 3.某同學(xué)為驗證酸性:醋酸>碳酸>苯酚,經(jīng)仔細考慮,設(shè)計如下實驗裝置,請回答下列問題:
3.某同學(xué)為驗證酸性:醋酸>碳酸>苯酚,經(jīng)仔細考慮,設(shè)計如下實驗裝置,請回答下列問題:
(1)A處的試劑是(填序號,下同),B處的試劑是。
①醋酸溶液
②CH3COONa溶液
③苯酚溶液
④苯酚鈉溶液
(2)裝置Ⅱ中飽和NaHCO3溶液的作用。
(3)能證明三種酸的酸性強弱的現(xiàn)象。
(4)寫出裝置Ⅲ中發(fā)生反應(yīng)的化學(xué)方程式:。發(fā)布:2024/8/16 0:0:1組卷:67引用:2難度:0.6
相關(guān)試卷


