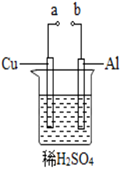
 某興趣小組為研究原電池原理,設計如圖裝置。
某興趣小組為研究原電池原理,設計如圖裝置。
(1)a和b用導線連接,Cu極為原電池 正正極(填“正”或“負”),電極反應式是:2H++2e-=H2↑2H++2e-=H2↑;Al極發生 氧化氧化(填“氧化”或“還原”)反應,其電極反應式為:Al-3e-=Al3+Al-3e-=Al3+,溶液中SO42-移向 AlAl。(填“Cu”或“Al”極);當負極金屬溶解5.4g時,0.60.6NA電子通過導線。
(2)若a與電源正極相連,Cu電極反應式為:Cu-2e-=Cu2+Cu-2e-=Cu2+;Al電極產生氣體為 H2H2。
【考點】原電池原理的應用.
【答案】正;2H++2e-=H2↑;氧化;Al-3e-=Al3+;Al;0.6;Cu-2e-=Cu2+;H2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:33引用:1難度:0.7
相似題
-
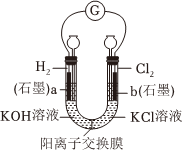 1.用如圖裝置進行實驗,電流計指針偏轉。下列說法不正確的是( )
1.用如圖裝置進行實驗,電流計指針偏轉。下列說法不正確的是( )A.該裝置將化學能轉化為電能 B.K+從a極經陽離子交換膜移向b極 C.工作一段時間,a極附近溶液pH會減小 D.該裝置的總反應為H2+Cl2═2HCl 發布:2024/12/17 8:30:2組卷:185引用:3難度:0.7 -
2.Li-SO2電池具有優良的性能,其工作原理如圖所示。下列說法正確的是( )
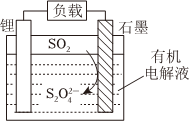
A.金屬Li為正極 B.電子流動方向為:鋰電極→有機電解液→石墨電極 C.石墨電極的電極反應式為2SO2+2e-═S2 O2-4D.有機電解液可以換成水性電解液 發布:2024/12/8 11:30:1組卷:162引用:1難度:0.7 -
3.鹽酸羥胺(NH2OH?HCl)用途廣泛,可利用如圖裝置來制備。以鹽酸為離子導體,向兩電極分別通入NO和H2。下列說法正確的是( )

A.Pt電極為原電池的正極 B.Cl-通過離子交換膜到右極室 C.一段時間后,含Fe的催化電極所在極室的pH增大 D.每生成1mol鹽酸羥胺電路中轉移4mole- 發布:2024/12/8 5:30:2組卷:210引用:7難度:0.5


