2021-2022學(xué)年陜西省西安市雁塔二中高二(上)第一次月考化學(xué)試卷
發(fā)布:2024/12/24 1:0:2
一、單選題(本大題共30小題,共60分)
-
1.日常生活中的下列做法,與調(diào)控化學(xué)反應(yīng)速率無關(guān)的是( )
A.燃煤時(shí)將煤塊粉碎為煤粉 B.制作綠豆糕時(shí)添加適量的食品防腐劑 C.空運(yùn)水果時(shí)在包裝箱中放入冰袋 D.煉鐵時(shí)采用增加爐子高度的方法減少尾氣排放 組卷:16引用:2難度:0.5 -
2.利用反應(yīng)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.8kJ?mol-1,可凈化汽車尾氣,如果要同時(shí)提高該反應(yīng)的速率和NO的轉(zhuǎn)化率,采取的措施是( )
A.降低溫度 B.增大壓強(qiáng)同時(shí)加催化劑 C.升高溫度同時(shí)充入N2 D.及時(shí)將CO2和N2從反應(yīng)體系中移走 組卷:89引用:14難度:0.6 -
3.反應(yīng)4A(s)+3B(g)?2C(g)+D(g),經(jīng)2minB的濃度減少0.6mol?L-1。對(duì)此反應(yīng)速率的正確表示是( )
A.用A表示的反應(yīng)速率是0.4mol?L-1?s-1 B.在2min末時(shí)的反應(yīng)速率,用產(chǎn)物C來表示是0.2mol?L-1?min-1 C.分別用A、B、C、D表示反應(yīng)的速率,其比值是4:3:2:1 D.在這2min內(nèi)用B和C表示的反應(yīng)速率的值都是不同的 組卷:19引用:3難度:0.7 -
4.對(duì)反應(yīng)2A(g)+B(s)?3C(g)+4D(g)來說,下列反應(yīng)速率最快的是( )
A.v(A)=0.5mol/(L?min) B.v(B)=0.01mol/(L?s) C.v(C)=1.0mol/(L?min) D.v(D)=1.2mol/(L?min) 組卷:23引用:5難度:0.5 -
5.在密閉真空容器中加入一定量純凈的氨基甲酸銨固體(假設(shè)容器體積不變,固體試樣體積忽略不計(jì)),在恒溫下使其達(dá)到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g) ΔH>0;下列說法中正確的是( )
A.密閉容器中氣體的平均相對(duì)分子質(zhì)量不變則該反應(yīng)達(dá)到平衡狀態(tài) B.該反應(yīng)在任何條件下能自發(fā)進(jìn)行 C.再加入一定量氨基甲酸銨,可加快反應(yīng)速率 D.保持溫度不變,壓縮體積,達(dá)到新的平衡時(shí),NH3的濃度不變 組卷:11引用:2難度:0.6 -
 6.三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料,在催化劑作用下可發(fā)生反應(yīng):2SiHCl3(g)?SiH2Cl2(g)+SiCl4(g),在50℃和70℃時(shí)SiHCl3的轉(zhuǎn)化率隨時(shí)間變化的結(jié)果如圖所示。下列敘述不正確的是( )
6.三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料,在催化劑作用下可發(fā)生反應(yīng):2SiHCl3(g)?SiH2Cl2(g)+SiCl4(g),在50℃和70℃時(shí)SiHCl3的轉(zhuǎn)化率隨時(shí)間變化的結(jié)果如圖所示。下列敘述不正確的是( )A.該反應(yīng)為吸熱反應(yīng) B.反應(yīng)速率大小:va>vb C.70℃時(shí),平衡常數(shù)K=0.112/0.782 D.增大壓強(qiáng),可以提高SiHCl3的平衡轉(zhuǎn)化率,縮短達(dá)平衡的時(shí)間 組卷:31引用:7難度:0.5 -
 7.某密閉容器中發(fā)生反應(yīng):X(g)+3Y(g)?2Z(g)△H<0.如圖表示該反應(yīng)的速率(v)隨時(shí)間(t)變化的關(guān)系,t2、t3、t5時(shí)刻外界條件有所改變,但都沒有改變各物質(zhì)的初始加入量.下列說法中正確的是( )
7.某密閉容器中發(fā)生反應(yīng):X(g)+3Y(g)?2Z(g)△H<0.如圖表示該反應(yīng)的速率(v)隨時(shí)間(t)變化的關(guān)系,t2、t3、t5時(shí)刻外界條件有所改變,但都沒有改變各物質(zhì)的初始加入量.下列說法中正確的是( )A.t2時(shí)加入了催化劑 B.t3時(shí)平衡的移動(dòng)可使化學(xué)平衡常數(shù)減小 C.t5時(shí)增大了壓強(qiáng) D.t6時(shí)達(dá)到平衡后反應(yīng)物的轉(zhuǎn)化率最大 組卷:23引用:3難度:0.7 -
8.一定條件下,可逆反應(yīng)2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0達(dá)到平衡,當(dāng)單獨(dú)改變下述條件后,有關(guān)敘述錯(cuò)誤的是( )
A.加催化劑,v正、v逆都發(fā)生變化,且變化的程度相等 B.加壓,v正、v逆都增大,且v正增大的程度大于v逆增大的程度 C.降溫,v正、v逆都減小,且v正減小的程度小于v逆減小的程度 D.增大氮?dú)獾臐舛鹊臅r(shí)刻v正、v逆增大,且v逆增大程度大于v正增大程度 組卷:10引用:3難度:0.6 -
 9.工業(yè)上可通過甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)=HCOOCH3(g),在容積固定的密閉容器中,投入等物質(zhì)的量CH3OH和CO,測(cè)得相同時(shí)間內(nèi)CO的轉(zhuǎn)化率隨溫度變化如圖所示。下列說法不正確的是( )
9.工業(yè)上可通過甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)=HCOOCH3(g),在容積固定的密閉容器中,投入等物質(zhì)的量CH3OH和CO,測(cè)得相同時(shí)間內(nèi)CO的轉(zhuǎn)化率隨溫度變化如圖所示。下列說法不正確的是( )A.增大壓強(qiáng)甲醇轉(zhuǎn)化率增大 B.b點(diǎn)反應(yīng)速率υ正=υ逆 C.平衡常數(shù)K(75℃)>K(85℃),反應(yīng)速率υb<υd D.生產(chǎn)時(shí)反應(yīng)溫度控制在80~85℃為宜 組卷:196引用:14難度:0.8 -
10.對(duì)于可逆反應(yīng):A(g)+B(g)?C(g) ΔH<0,下列各圖正確的是( )
A. 
B. 
C. 
D.  組卷:28引用:4難度:0.7
組卷:28引用:4難度:0.7 -
 11.T℃時(shí),在2L的密閉容器中,氣體X、Y和Z三種物質(zhì)的物質(zhì)的量隨時(shí)間變化的曲線如圖所示,下列描述正確的是( )
11.T℃時(shí),在2L的密閉容器中,氣體X、Y和Z三種物質(zhì)的物質(zhì)的量隨時(shí)間變化的曲線如圖所示,下列描述正確的是( )A.容器中化學(xué)反應(yīng)為X(g)+Y(g)?Z(g) B.0~10s,X表示的平均化學(xué)反應(yīng)速率為0.04mol/(L?s) C.使用催化劑只能加快0~10s間的反應(yīng)速率 D.0~4s的平均反應(yīng)速率小于0~10s的平均反應(yīng)速率 組卷:23引用:2難度:0.7
二、填空題(本大題共4小題,共40分)
-
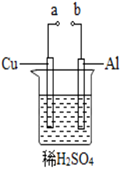 33.某興趣小組為研究原電池原理,設(shè)計(jì)如圖裝置。
33.某興趣小組為研究原電池原理,設(shè)計(jì)如圖裝置。
(1)a和b用導(dǎo)線連接,Cu極為原電池極(填“正”或“負(fù)”),電極反應(yīng)式是:;Al極發(fā)生(填“氧化”或“還原”)反應(yīng),其電極反應(yīng)式為:,溶液中SO42-移向。(填“Cu”或“Al”極);當(dāng)負(fù)極金屬溶解5.4g時(shí),NA電子通過導(dǎo)線。
(2)若a與電源正極相連,Cu電極反應(yīng)式為:;Al電極產(chǎn)生氣體為。組卷:32引用:1難度:0.7 -
34.回答下列化學(xué)平衡相關(guān)問題:
(1)工業(yè)制硫酸的核心反應(yīng)是:2SO2(g)+O2(g)?2SO3(g) ΔH<0。
①在1L密閉容器中充入1molSO2(g)和2molO2(g),在1min內(nèi)達(dá)到平衡,測(cè)得v(SO3)=0.8mol/(L?min)。該條件下,反應(yīng)的平衡常數(shù)K=。
②下列措施中有利于提高SO2轉(zhuǎn)化率的是(填字母)。
A.加入催化劑
B.通入O2
C.移出SO3
(2)將水蒸氣通過紅熱的碳即可產(chǎn)生水煤氣,C(s)+H2O(g)?CO(g)+H2(g) ΔH=+131.3kJ?mol-1,ΔS=+133.7J?(K?mol)-1
①該反應(yīng)在能自發(fā)(填“高溫”、“低溫”、“任何溫度”、“一定不”)。
②一定溫度下,在一個(gè)恒容密閉容器中發(fā)生上述反應(yīng),下列能判斷該反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的是(填字母)。
A.c(CO)=c(H2)
B.1molH-H鍵斷裂的同時(shí)生成2molH-O鍵
C.容器中的壓強(qiáng)不變
D.v正(CO)=v逆(H2O)
(3)汽車尾氣含NO氣體是由于內(nèi)燃機(jī)燃燒的高溫引起氮?dú)夂脱鯕夥磻?yīng)所致:N2(g)+O2(g)?2NO(g) ΔH>0,已知該反應(yīng)在2404℃時(shí),平衡常數(shù)K=6.4×10-3,該溫度下,某時(shí)刻測(cè)得容器內(nèi)N2、O2、NO的濃度分別為2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此時(shí)反應(yīng)(填“處于化學(xué)平衡狀態(tài)”、“向正反應(yīng)方向進(jìn)行”或“向逆反應(yīng)方向進(jìn)行”)。組卷:10引用:2難度:0.5


