某興趣小組同學進行乙醛的銀鏡反應實驗的操作步驟如下:
A.在試管里先注入少量NaOH溶液,振蕩,然后加熱煮沸。把NaOH溶液倒去后,再用蒸餾水洗凈試管備用。
B.在洗凈的試管里配制銀氨溶液。
C.沿試管壁加入乙醛稀溶液。
D.加熱。
請回答下列問題:
(1)步驟A中加NaOH溶液振蕩,加熱煮沸的目的是 除去試管內壁的油污,保證試管潔凈除去試管內壁的油污,保證試管潔凈。
(2)簡述銀氨溶液的配制過程:在潔凈的試管里加入1 mL 2%的AgNO3溶液,然后一邊搖動試管,一邊逐滴滴入2%的稀氨水,至最初產生的沉淀恰好溶解為止在潔凈的試管里加入1 mL 2%的AgNO3溶液,然后一邊搖動試管,一邊逐滴滴入2%的稀氨水,至最初產生的沉淀恰好溶解為止。
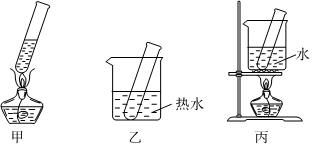
(3)步驟D應選擇的加熱方法是 丙丙(填下列裝置編號),理由是 為了受熱均勻,采用熱水浴加熱,裝置丙符合要求為了受熱均勻,采用熱水浴加熱,裝置丙符合要求。
(4)乙醛發生銀鏡反應的化學方程式 CH3CHO+2Ag(NH3)2OH水浴CH3COONH4+2Ag↓+3NH3+H2OCH3CHO+2Ag(NH3)2OH水浴CH3COONH4+2Ag↓+3NH3+H2O。
(5)該興趣小組的同學還對乙醛進行銀鏡反應的最佳實驗條件進行了探究(部分實驗數據如下表):
水浴
水浴
| 實驗變量 實驗序號 |
銀氨溶液的量/mL | 乙醛的量/滴 | 溫度/℃ | 反應混合液的pH | 出現銀鏡的時間/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
溫度對反應速率的影響
溫度對反應速率的影響
。②當銀氨溶液的量為1mL,乙醛的量為3滴,溫度為50℃,反應混合液pH為11時,出現銀鏡的時間
5~6.5min
5~6.5min
。(填范圍)③你認為探究乙醛進行銀鏡反應的最佳條件,除了測量銀鏡出現的時間外,還需要比較不同條件下形成銀鏡的
光亮程度
光亮程度
。
【考點】性質實驗方案的設計.
【答案】除去試管內壁的油污,保證試管潔凈;在潔凈的試管里加入1 mL 2%的AgNO3溶液,然后一邊搖動試管,一邊逐滴滴入2%的稀氨水,至最初產生的沉淀恰好溶解為止;丙;為了受熱均勻,采用熱水浴加熱,裝置丙符合要求;CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O;溫度對反應速率的影響;5~6.5min;光亮程度
水浴
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:34引用:1難度:0.4
相似題
-
1.如圖是在實驗室進行二氧化硫制備與性質實驗的組合裝置,部分固定裝置未畫出。
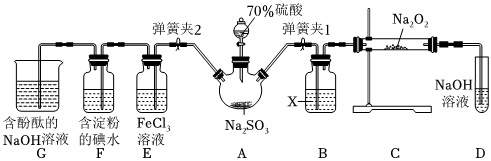
(1)在組裝好裝置后,若要檢驗A~D裝置的氣密性,其操作是首先,然后往D中裝入水,然后微熱A,觀察到D中有氣泡冒出,移開酒精燈或松開雙手,D中導管有水柱形成且高度保持不變,說明裝置氣密性良好。
(2)裝置D中盛放NaOH溶液的作用是。
(3)關閉彈簧夾1后,打開彈簧夾2,殘余氣體進入E、F、G中,能說明I-還原性弱于SO2的現象為;發生反應的離子方程式是。
(4)為了驗證E中SO2與FeCl3發生了氧化還原反應,設計了如下實驗:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,產生白色沉淀,說明SO2與FeCl3發生了氧化還原反應。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)實驗過程中G中含酚酞的NaOH溶液逐漸褪色,此實驗證明SO2具有漂白性還是其溶于水顯酸性?請設計實驗驗證:。發布:2024/12/30 14:0:1組卷:29引用:2難度:0.5 -
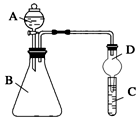 2.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
2.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
Ⅰ.(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:與鹽酸反應最劇烈,與鹽酸反應產生的氣體最多。(填元素符號)
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為:。
Ⅱ.利用如圖裝置可驗證同主族元素非金屬性的變化規律
(1)儀器A的名稱為。
(2)實驗室中現有藥品:①稀鹽酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固體,請選擇合適藥品設計實驗驗證 N、C、Si的非金屬性的變化規律;裝置A、B中所裝藥品分別為、。(填序號)但有同學認為該裝置有缺陷,如何改進?。發布:2024/12/30 14:30:1組卷:19引用:2難度:0.5 -
3.某化學興趣小組為探究銅跟濃硫酸的反應,用圖裝置進行有關實驗.請回答下列問題:
(1)裝置A中發生的化學反應的化學方程式為.
(2)裝置B 的作用是貯存多余的氣體,B中廣口瓶內應盛放的液體是(填序號)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④飽和的NaHSO3溶液
(3)裝置C和D 中產生的現象相同,但原因卻不同.用離子方程式和必要的文字解釋C中溶液褪色的原因
(4)裝置D中試管口塞一團棉花,棉花中應浸有一種液體,這種液體是.
(5)實驗完畢,待A中燒瓶內液體冷卻后,過濾,向濾液中加入少量的蒸餾水稀釋,溶液為藍色.為了證明藍色只與Cu2+有關,而與其它離子無關,某同學設計了下列實驗,其中對實驗目的沒有意義的是(填序號)
①觀察稀H2SO4 溶液呈無色 ②觀察CuSO4 粉末呈白色 ③稀釋CuSO4溶液,溶液藍色變淺 ④往CuSO4溶液中加入足量NaOH溶液,生成藍色沉淀,過濾,濾液呈無色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,過濾,濾液仍顯藍色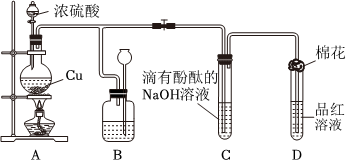 發布:2024/12/30 14:30:1組卷:13引用:2難度:0.7
發布:2024/12/30 14:30:1組卷:13引用:2難度:0.7


