九年級化學下冊教材有下列表述:“在金屬活動性順序里,位于氫前面的金屬能置換出鹽酸、稀硫酸中的氫”。
(提出問題)小明同學在閱讀課本時提出問題,稀鹽酸和濃鹽酸反應是否相同?位于氫前面的金
屬能置換濃鹽酸中的氫嗎?于是他和同學們一起進行了實驗探究。
(實驗探究1)小明同學設計了下列實驗方案,并記錄了實驗現象:
| 實驗 | 固體藥品 | 液體藥品 | 現象 |
| ① | 鐵片5g | 5%的鹽酸25mL | 有無色無味的氣體產生,反應速度較慢 |
| ② | 鐵片5g | 37%的鹽酸25mL | 有無色無味的氣體產生,反應速度很快 |
FeCl2
FeCl2
。(2)上述實驗設計的思想方法是
對比
對比
。(3)經驗證實驗①和②產生的氣體均為H2,由此小明同學得出位于氫前面的金屬能置換出稀鹽酸和濃鹽酸中的氫;由上述實驗還能得出的結論是
其它條件相同時,鹽酸濃度越大,反應速率越快
其它條件相同時,鹽酸濃度越大,反應速率越快
。(實驗探究2)甲乙丙丁四位同學分別做了如上四個實驗,觀察現象,并進行對比

(1)甲同學觀察有氣泡產生,寫出反應的化學方程式
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
。(2)乙同學的實驗現象說明,濃度的改變也會影響物質的
化學
化學
(填“化學”或“物理”)性質。(3)丙同學實驗時發現產生氣泡的速度比甲同學快,說明升高
溫度
溫度
能使反應加快。(4)丁同學實驗時聞到有刺激性氣味的氣體產生。后經查閱資料和實驗驗證得知該氣體是導致酸雨的主要物質,則該氣體是
SO2
SO2
(寫化學式)。該實驗說明,鋅和濃硫酸在加熱時能發生反應,反應類型 不是
不是
(填“是”或“不是”)置換反應。(評價反思)在探究酸的化學性質時,教材中的原話強調稀硫酸的原因是:
常溫時某些金屬不能和濃硫酸反應,加熱時濃硫酸和某些金屬發生的不是置換反應
常溫時某些金屬不能和濃硫酸反應,加熱時濃硫酸和某些金屬發生的不是置換反應
。【答案】FeCl2;對比;其它條件相同時,鹽酸濃度越大,反應速率越快;Zn+H2SO4═ZnSO4+H2↑;化學;溫度;SO2;不是;常溫時某些金屬不能和濃硫酸反應,加熱時濃硫酸和某些金屬發生的不是置換反應
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:15引用:1難度:0.5
相似題
-
1.根據圖示設計的實驗來進一步認識金屬的化學性質和金屬的活動性順序。

(1)寫出實驗A中反應的化學方程式:。
(2)實驗B中可觀察到鐵片的表面出現,說明鐵的金屬活動性比銅(填“強”或“弱”)。
(3)若想探究鎂、鐵、銅三種金屬的活動性強弱,小清同學提出在實驗B的基礎上增加實驗甲和乙,便可得出結論。試管內的鎂片和鐵片表面均被打磨潔凈,且形狀、大小相同;同時加入等質量和等濃度的稀硫酸。
①乙裝置中發生反應的化學方程式為。
②觀察到試管中有氣泡產生且長頸漏斗中甲的液面上升比乙(填“快”或“慢”)時,可以證明鎂的金屬活動性比鐵的強。
③若甲、乙實驗所用的金屬均過量,則甲裝置中產生的H2質量(填“大于”“小于”或“等于”)乙裝置中產生的H2質量。
④小亮同學指出若想探究這三種金屬的活動性強弱,只需使用三種藥品即可達到實驗目的,請你幫助小亮完成其實驗方案。操作 現象 結論 將鎂片和銅片分別放入氯化亞鐵溶液中 放入銅片的氯化亞鐵溶液中 ,放入鎂片的氯化亞鐵溶液的顏色由金屬的活動性強弱關系為Mg>Fe>Cu 發布:2024/12/7 8:0:1組卷:77引用:1難度:0.5 -
2.化學小組為探究鐵、銅、鋅、銀的金屬活動性順序,設計如下三個實驗(其中金屬均已打磨,其形狀、大小及同種稀鹽酸的用量均相同):
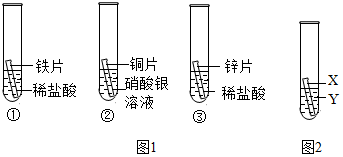
(1)實驗①的化學方程式為;一段時間后,觀察到實驗②的銅片表面有銀白色固體附著,這說明銅比銀的活動性(填“強”或“弱”)。
(2)甲同學認為通過實驗①和③可比較鋅和鐵的金屬活動性,他依據的實驗現象是。
(3)乙、丙兩位同學認為上述實驗方案不足以得出四種金屬的活動順序,并在上述實驗的基礎上,利用金屬
不同的化學性質分別補充了一個實驗(圖2所示),都實現了探究的目的。乙同學的實驗:X是金屬,Y是溶液;丙同學的實驗:X是金屬,Y是溶液。發布:2024/12/25 17:30:2組卷:45引用:4難度:0.5 -
3.2019年版第五套人民幣5角硬幣的材質已由“鋼芯鍍銅合金”改為“鋼芯鍍鎳”,其表面色澤也因此由
色變為銀白色。化學興趣小組決定,探究制造5角硬幣的三種主要金屬(鐵、銅、鎳)活動性順序。
【查閱資料】
(1)硫酸鎳溶液顯綠色,Ni的化合價通常為+2價。
(2)鎳能與稀硫酸反應,生成硫酸鎳和氫氣。
【提出猜想】猜想①:;猜想②:Fe>Ni>Cu。
【實驗探究】
(1)甲組同學將一塊表面潔凈的鎳片放入稀硫酸中,觀察到的實驗現象是,有關反應的化學方程式是。
(2)乙組同學將一塊表面潔凈的鎳片浸入硫酸亞鐵溶液中,一會兒取出,發現鎳片表面無明顯變化,說明猜想(填“①”或“②”)成立。
(3)丙組同學用銅片、硫酸鎳溶液和進行實驗,也得出了三種金屬的活動性順序。
【拓展延伸】
(1)某電鍍公司的檢修員利用工作之便,將鎳網放入含有金鹽的電鍍液中偷偷“吸取”黃金,該盜竊手法利用了(填反應的基本類型)原理。該員工竊取貴重物品的行為,必將受到法律的制裁。
(2)金屬活動性實際上是金屬在水溶液中失去電子的能力大小。下列事實可以判斷M、N兩種金屬活動性順序的是(填序號)。
①M能和鹽酸反應而N不能
②M、N分別放入鹽酸中比較反應劇烈程度
③常溫下M能與氧氣反應而N不能
④M能從N的鹽溶液中置換出N發布:2024/12/25 14:0:2組卷:229引用:5難度:0.5


