FeCl3是中學實驗室常用的試劑。
(1)寫出氯化鐵在水中的電離方程式:FeCl3=Fe3++3Cl-FeCl3=Fe3++3Cl-。
(2)利用氯化鐵溶液制備氫氧化鐵膠體。
①下列制備氫氧化鐵膠體的操作方法正確的是DD(填字母)。
A.向飽和氯化鐵溶液中滴加適量的氫氧化鈉稀溶液
B.加熱煮沸氯化鐵飽和溶液
C.在氨水中滴加氯化鐵濃溶液
D.在沸水中滴加飽和氯化鐵溶液,煮沸至出現紅褐色液體
②區別氯化鐵溶液和氫氧化鐵膠體的方法是:丁達爾效應,有丁達爾效應的是氫氧化鐵膠體,無丁達爾效應的是氯化鐵溶液丁達爾效應,有丁達爾效應的是氫氧化鐵膠體,無丁達爾效應的是氯化鐵溶液。
(3)為了探究離子反應的本質,設計如下實驗:
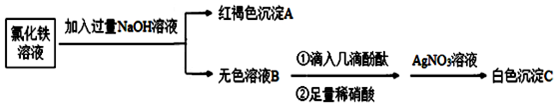
①寫出生成A的離子方程式:Fe3++3OH-=Fe(OH)3↓Fe3++3OH-=Fe(OH)3↓。
②上述流程中,加入足量稀硝酸的目的是中和過量的氫氧化鉀,排除雜質離子干擾;中和過量的氫氧化鉀,排除雜質離子干擾;;如何判定無色溶液B與稀硝酸發生了離子反應?溶液由紅色變無色溶液由紅色變無色。
【答案】FeCl3=Fe3++3Cl-;D;丁達爾效應,有丁達爾效應的是氫氧化鐵膠體,無丁達爾效應的是氯化鐵溶液;Fe3++3OH-=Fe(OH)3↓;中和過量的氫氧化鉀,排除雜質離子干擾;;溶液由紅色變無色
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:131引用:4難度:0.8
相似題
-
1.日常生活中我們會接觸到不同的分散系。
(1)溶液、膠體和濁液這三種分散系的根本區別是。
A.是否有丁達爾現象
B.能否透過濾紙
C.分散質粒子直徑的大小
D.是否均一、穩定、透明
(2)下列實驗裝置或操作與粒子的大小無直接關系的是。
(3)將10mL淀粉膠體和5mL氯化鈉溶液混合后,放入用半透膜制成的袋內,將此袋浸入蒸餾水中(如圖所示)2min后,分別取袋內和燒杯內液體進行實驗,下列說法正確的是。
A.燒杯內液體加入碘水后呈藍色
B.燒杯內液體加入硝酸銀溶液后有白色沉淀產生
C.袋內液體加入硝酸銀溶液后無變化
D.袋內液體加入碘水后不變藍
(4)制備Fe(OH)3膠體時,將逐滴滴加至中,待液體呈紅褐色后,停止加熱;反應方程式為。發布:2024/10/6 10:0:2組卷:16引用:1難度:0.5 -
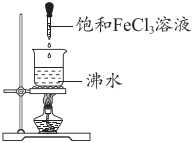 2.如圖所示為實驗室中制備膠體的一種方法。下列說法正確的是( )
2.如圖所示為實驗室中制備膠體的一種方法。下列說法正確的是( )A.該制備方法屬于物理方法 B.燒杯中液體的顏色逐漸變淺 C.可用丁達爾效應判斷是否制得膠體 D.加熱能促使該分散系中的分散質粒子直徑減小 發布:2024/12/11 4:0:1組卷:90引用:5難度:0.8 -
3.關于氫氧化鐵膠體,下列說法正確的是( )
A.Fe(OH)3膠體有丁達爾效應,是由于膠體粒子對光的衍射 B.制備Fe(OH)3膠體時需要加熱至煮沸,且加熱時間越長越好 C.Fe(OH)3膠體是固溶膠,其分散質粒子直徑為1~100nm D.Fe(OH)3膠體具有凈水功能 發布:2024/10/6 4:0:1組卷:17引用:1難度:0.5


