砷(As)是一些工廠和礦山廢水中的污染元素,使用吸附劑是去除水中砷的有效措施之一.
(1)將硫酸錳、硝酸釔與氫氧化鈉溶液按一定比例混合,攪拌使其充分反應,可獲得一種砷的高效吸附劑X,吸附劑X中含有CO2-3,其原因是 堿性溶液吸收了空氣中的CO2堿性溶液吸收了空氣中的CO2.
(2)H3AsO3和H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系分別如圖-1和圖-2所示.
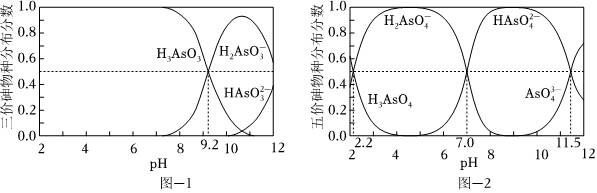
①以酚酞為指示劑(變色范圍pH 8.0~10.0),將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為淺紅色時停止滴加.該過程中主要反應的離子方程式為 OH-+H3AsO3=H2AsO-3+H2OOH-+H3AsO3=H2AsO-3+H2O.
②H3AsO4第一步電離方程式H3AsO4?H2AsO-4+H+的電離常數為Ka1,則pKa1=2.22.2(p Ka1=-lg Ka1 ).
(3)溶液的pH對吸附劑X表面所帶電荷有影響.pH=7.1時,吸附劑X表面不帶電荷;pH>7.1時帶負電荷,pH越高,表面所帶負電荷越多;pH<7.1時帶正電荷,pH越低,表面所帶正電荷越多.pH不同時吸附劑X對三價砷和五價砷的平衡吸附量(吸附達平衡時單位質量吸附劑X吸附砷的質量)如圖-3所示.
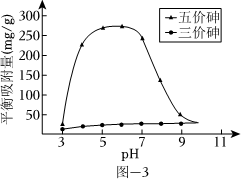
①在pH 7~9之間,吸附劑X對五價砷的平衡吸附量隨pH升高而迅速下降,其原因是 在pH7~9之間,隨pH升高H2AsO-4轉變為HAsO2-4,吸附劑X表面所帶負電荷增多,靜電斥力增加在pH7~9之間,隨pH升高H2AsO-4轉變為HAsO2-4,吸附劑X表面所帶負電荷增多,靜電斥力增加.
②在pH 4~7之間,吸附劑X對水中三價砷的去除能力遠比五價砷的弱,這是因為 在pH4~7之間,吸附劑X表面帶正電,五價砷主要以H2AsO-4和HAsO2-4陰離子存在,靜電引力較大;而三價砷主要以H3AsO3分子存在,與吸附劑X表面產生的靜電引力小在pH4~7之間,吸附劑X表面帶正電,五價砷主要以H2AsO-4和HAsO2-4陰離子存在,靜電引力較大;而三價砷主要以H3AsO3分子存在,與吸附劑X表面產生的靜電引力小.提高吸附劑X對三價砷去除效果可采取的措施是 加入氧化劑,將三價砷轉化為五價砷加入氧化劑,將三價砷轉化為五價砷.
CO
2
-
3
A
s
O
-
3
A
s
O
-
3
A
s
O
-
4
A
s
O
-
4
HA
s
O
2
-
4
A
s
O
-
4
HA
s
O
2
-
4
A
s
O
-
4
HA
s
O
2
-
4
A
s
O
-
4
HA
s
O
2
-
4
【考點】弱電解質的電離平衡.
【答案】堿性溶液吸收了空氣中的CO2;OH-+H3AsO3=H2+H2O;2.2;在pH7~9之間,隨pH升高H2轉變為,吸附劑X表面所帶負電荷增多,靜電斥力增加;在pH4~7之間,吸附劑X表面帶正電,五價砷主要以H2和陰離子存在,靜電引力較大;而三價砷主要以H3AsO3分子存在,與吸附劑X表面產生的靜電引力小;加入氧化劑,將三價砷轉化為五價砷
A
s
O
-
3
A
s
O
-
4
HA
s
O
2
-
4
A
s
O
-
4
HA
s
O
2
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:1316引用:11難度:0.3
相似題
-
1.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
2.25℃時,用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數,則下列各式表 示的數值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
3.將0.1mol?L-1的醋酸溶液加水稀釋,則( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動,c(CH3COO-)增大 C.平衡向電離方向移動,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


