2020-2021學年江蘇省鎮江一中高二(下)段考化學試卷(4月份)
發布:2024/12/19 15:30:2
一、選擇題(本題包括13小題,每小題3分,共39分;每小題只有一個選項符合題意)
-
1.為延長艦船服役壽命可采用的電化學防腐的方法有①艦體與直流電源相連②艦體上鑲嵌某種金屬塊。下列有關說法正確的是( )
A.方法①中艦體應連電源的正極 B.方法②中鑲嵌金屬塊可以是鋅 C.方法①為犧牲陽極的陰極保護法 D.方法②為外加電流的陰極保護法 組卷:183引用:3難度:0.9 -
2.如圖是可逆反應A+2B?2C+3D的化學反應速率與化學平衡隨外界條件改變(先降溫后加壓)而變化的情況.由此可推斷( )

A.正反應是放熱反應 B.D可能是氣體 C.逆反應是放熱反應 D.A、B、C、D均為氣體 組卷:376引用:7難度:0.7 -
3.活潑自由基與氧氣的反應一直是關注的熱點。HNO自由基與O2反應過程的能量變化如圖所示。下列說法正確的是( )
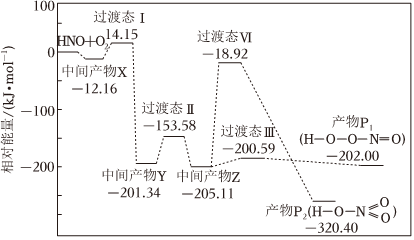
A.該反應為吸熱反應 B.產物的穩定性:P1>P2 C.該歷程中最大正反應的活化能E正=186.19kJ?mol-1 D.相同條件下,由中間產物z轉化為產物的速率:v(P1)<v(P2) 組卷:254引用:24難度:0.8 -
4.據報道,在300℃、70MPa下由二氧化碳和氫氣合成乙醇已成為現實。2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) 下列敘述錯誤的是( )
A.使用Cu-Zn-Fe催化劑可大大提高生產效率 B.反應需在300℃進行可推測該反應是吸熱反應 C.充入大量CO2氣體可提高H2的轉化率 D.從平衡混合氣體中分離出CH3CH2OH和H2O可提高CO2和H2的利用率 組卷:677引用:45難度:0.7 -
5.N2O5是一種新型硝化劑,在一定溫度下可以發生以下反應:2N2O5(g)?4NO2(g)+O2(g)△H>0。T1溫度時,向密閉容器中通入N2O5,部分實驗數據見下表
下列說法中不正確的是( )時間/s 0 500 1000 1500 c(N2O5)/mol?L-1 5.00 3.52 2.50 2.50 A.500s內,N2O5的分解速率為2.96×10-3mol?L-1?s-1 B.T1溫度下的平衡常數K1=125,平衡時N2O5的轉化率為50% C.T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1<K2 D.T1時,4NO2(g)+O2(g)?2N2O5(g)的平衡常數為 1125組卷:50引用:3難度:0.5
二、非選擇題(4題共61分)
-
16.氧化還原滴定同中和滴定類似(用已知濃度的氧化劑溶液滴定未知濃度的還原劑溶液或反之)。現用0.1000mol?L-1KMnO4標準溶液測定K3[Fe(C2O4)3]樣品的純度。準確稱取1.000gK3[Fe(C2O4)3]樣品,加入適量水溶解并用稀硫酸酸化,加熱至80℃,趁熱用KMnO4標準溶液滴定至終點,消耗KMnO4標準溶液20.00mL。
請完成下列問題:
(1)實驗中用(填“酸”或“堿”)式滴定管盛裝酸性KMnO4溶液,原因是。
(2)本實驗(填“需要”或“不需要”)使用指示劑,滴定終點的現象是。
(3)寫出測定過程中反應的離子方程式。
(4)①計算樣品的純度(寫出計算過程):
②若滴定時所用的酸性KMnO4溶液因久置而導致濃度變小,則由此測得的待測樣品的純度會(填“偏小”“偏大”或“不變”)。組卷:24引用:1難度:0.6 -
17.砷(As)是一些工廠和礦山廢水中的污染元素,使用吸附劑是去除水中砷的有效措施之一.
(1)將硫酸錳、硝酸釔與氫氧化鈉溶液按一定比例混合,攪拌使其充分反應,可獲得一種砷的高效吸附劑X,吸附劑X中含有,其原因是CO2-3.
(2)H3AsO3和H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系分別如圖-1和圖-2所示.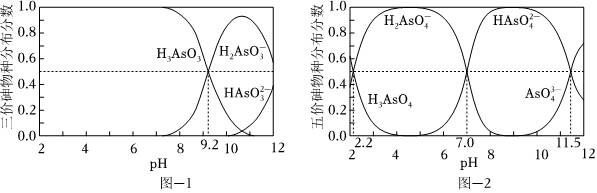
①以酚酞為指示劑(變色范圍pH 8.0~10.0),將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為淺紅色時停止滴加.該過程中主要反應的離子方程式為.
②H3AsO4第一步電離方程式H3AsO4?H2+H+的電離常數為Ka1,則pKa1=AsO-4(p Ka1=-lg Ka1 ).
(3)溶液的pH對吸附劑X表面所帶電荷有影響.pH=7.1時,吸附劑X表面不帶電荷;pH>7.1時帶負電荷,pH越高,表面所帶負電荷越多;pH<7.1時帶正電荷,pH越低,表面所帶正電荷越多.pH不同時吸附劑X對三價砷和五價砷的平衡吸附量(吸附達平衡時單位質量吸附劑X吸附砷的質量)如圖-3所示.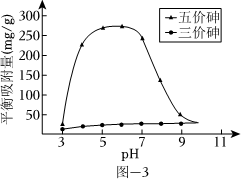
①在pH 7~9之間,吸附劑X對五價砷的平衡吸附量隨pH升高而迅速下降,其原因是.
②在pH 4~7之間,吸附劑X對水中三價砷的去除能力遠比五價砷的弱,這是因為.提高吸附劑X對三價砷去除效果可采取的措施是.組卷:1315引用:11難度:0.3


