常溫下,在二元弱酸H2C2O4(草酸)溶液中滴加NaOH溶液,所得混合溶液的pH與溶液中離子濃度比的對數值的關系分別如圖所示。

(1)寫出H2C2O4的電離方程式:H2C2O4?H++HC2O-4、HC2O-4?H++C2O2-4H2C2O4?H++HC2O-4、HC2O-4?H++C2O2-4。
(2)lgc(HC2O4-)c(H2C2O4)與pH關系是曲線 MM(填“M”或“N”)。
(3)寫出e點時溶液中發生的主要離子反應方程式 H2C2O4+OH-=HC2O-4+H2OH2C2O4+OH-=HC2O-4+H2O。
(4)NaHC2O4溶液顯 酸酸(填“酸”或“堿”)性,請用數據說明:Kh(HC2O-4)=10-12.7,Ka(HC2O-4)=10-4.3,說明HC2O-4的電離大于水解Kh(HC2O-4)=10-12.7,Ka(HC2O-4)=10-4.3,說明HC2O-4的電離大于水解。
(5)已知:難溶物Ag2C2O4的Ksp=5.0×10-12,在0.001mol/L10mL的Na2C2O4溶液中加入等體積、濃度至少為 2×10-42×10-4mol/L的AgNO3溶液時才能生成沉淀。
(6)查閱資料,草酸可與酸性高錳酸鉀發生如下反應:MnO-4+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。可利用酸性高錳酸鉀標準溶液滴定草酸并測取草酸溶液的濃度,滴定達到終點時現象為 當滴入最后一滴標準液時,溶液由無色變為紫紅色,且30s不變色當滴入最后一滴標準液時,溶液由無色變為紫紅色,且30s不變色。用0.1000mol/L酸性高錳酸鉀標準溶液滴定10.00mL草酸溶液時,消耗標準液的體積如下表。通過計算可知c(H2C2O4)=0.25000.2500mol/L。若滴定時所用的酸性高錳酸鉀溶液因久置導致濃度變小,則由此測得的c(H2C2O4)會 偏大偏大(填“偏大”、“偏小”或“不變”)。
O
-
4
O
-
4
O
2
-
4
O
-
4
O
-
4
O
2
-
4
c
(
H
C
2
O
4
-
)
c
(
H
2
C
2
O
4
)
O
-
4
O
-
4
O
-
4
O
-
4
O
-
4
O
-
4
O
-
4
O
-
4
M
n
O
-
4
| 初讀數V0(mL) | 末讀數V1(mL) | |
| 第一次 | 1.00 | 11.10 |
| 第二次 | 1.50 | 15.30 |
| 第三次 | 2.20 | 12.10 |
【考點】酸堿混合時的定性判斷及有關pH的計算;中和滴定.
【答案】H2C2O4?H++HC2、HC2?H++C2;M;H2C2O4+OH-=HC2+H2O;酸;Kh(HC2)=10-12.7,Ka(HC2)=10-4.3,說明HC2的電離大于水解;2×10-4;當滴入最后一滴標準液時,溶液由無色變為紫紅色,且30s不變色;0.2500;偏大
O
-
4
O
-
4
O
2
-
4
O
-
4
O
-
4
O
-
4
O
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:24引用:2難度:0.7
相似題
-
1.常溫下,在體積均為20mL、濃度均為0.1mol/L的HX溶液、HY溶液中分別滴加0.1mol/L的NaOH溶液,反應后溶液中水電離的c(H+)的負對數[-lgc(H+)水]與滴加氫氧化鈉溶液體積的關系如圖所示。下列推斷正確的是( )
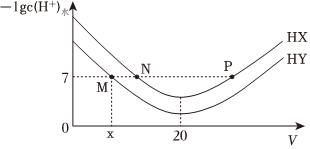
A.HX、HY均為弱酸且HX>HY B.P點溶液中c(Na+ )=c(X-)>c(H+)=c(OH-) C.常溫下用蒸餾水分別稀釋N、P點溶液,溶液pH都變小 D.常溫下,HY的電離常數Ka= x(20-x)×10-7發布:2024/12/15 2:30:7組卷:71引用:4難度:0.6 -
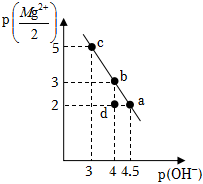 2.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2
2.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2A.a點溶液滿足:2c(Mg2+)+c( )<c(Cl-)NH+4B.b點溶液滿足:c( )>c(Cl-)>c(Mg2+)>c(OH-)NH+4C.c點溶液中通入NH3的量在標準狀況下的體積為22.4mL D.d點溶液中無Mg(OH)2沉淀產生 發布:2024/12/30 4:0:1組卷:23引用:2難度:0.5 -
3.下列說法正確的是( )
A.食鹽溶液中除去SO42- 最合適的試劑是Ba(NO3)2 B.NaCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 C.25℃時,用醋酸溶液中和等濃度NaOH溶液至pH=7,VCH3COOH<VNaOH D.AgCl易轉化為AgI沉淀且Ksp(AgX)=[Ag+]?[X-],故Ksp(AgI)<Ksp(AgCl) 發布:2025/1/1 8:0:2組卷:0引用:1難度:0.7


