2022-2023學年重慶市巴蜀中學高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(共18個小題,1至10題每題2分,11題至18題每題3分,共44分)
-
1.下列不包含d能級的能層是( )
A.L B.M C.N D.O 組卷:50引用:4難度:0.7 -
2.下列各組元素或化合物性質的遞變情況判斷不正確的是( )
A.原子半徑:As>P>N B.第一電離能:Cl>S>P C.電負性:O>N>C D.氫鹵化物水溶液的酸性:HI>HBr>HCl 組卷:18引用:3難度:0.8 -
3.下列離子方程式表述正確的是( )
A.電解法冶煉金屬鋁:2A13++6Cl- 2Al+3Cl2↑電解B.小蘇打溶液顯堿性:HCO3-+H2O?CO32-+H3O+ C.偏鋁酸鈉和小蘇打溶液混合產生沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- D.用鐵電極電解飽和食鹽水:2Cl-+2H2O 2OH-+H2↑+Cl2↑電解組卷:11引用:2難度:0.6 -
4.一種可充電電池放電時的總反應為:H2+2NiO(OH)=2Ni(OH)2,當為該電池充電時,與外電源正極連接的電極上發生的反應是( )
A.H2被氧化 B.NiO(OH)被還原 C.Ni(OH)2 被氧化 D.Ni(OH)2 被還原 組卷:12引用:2難度:0.5 -
5.下列有關阿伏加德羅常數的說法正確的是(NA代表阿伏加德羅常數的值)( )
A.用電解法精煉銅時,若陽極質量減輕64g,電路中轉移電子數目為2NA B.將lmolNH4NO3溶于稀氨水,溶液呈中性時NH4+數目為NA C.一定溫度下,pH=6的純水中OH-的數目為10-6NA D.100mL1mol/LAlCl3溶液中Al3+數目為0.1NA 組卷:23引用:3難度:0.6 -
6.下列有關元素周期表的說法正確的是( )
A.元素周期表中,從第ⅢB族到第ⅡB族的10個縱列的元素全都是金屬元素 B.元素周期表的各個周期總是從ns能級開始,以mp能級結束 C.元素周期表中,氟元素的電負性最大,第一電離能也最大 D.按照核外電子排布,可把元素周期表劃分為s、p、d、f四個區 組卷:21引用:2難度:0.8 -
7.下列有關圖示原電池裝置的敘述正確的是( )
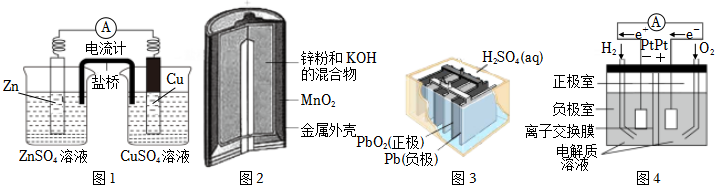
A.圖1鹽橋中的陽離子移向ZnSO4溶液 B.圖2中Zn發生還原反應,MnO2發生氧化反應 C.圖3中電池放電時,負極質量減少,正極質量增加 D.圖4電解質溶液采用稀硫酸時,正極反應為O2+4H++4e-=2H2O 組卷:42引用:7難度:0.5
二、非選擇題(共4個小題,共56分)
-
21.電化學原理在能量轉化,物質制備及環境保護等領域均有廣泛應用,請按要求回答下列問題:
Ⅰ.(1)1977年,伏打電堆的發明為電化學的創建開辟了道路,某化學興趣小組在閱讀了相關材料后,想把反應3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O設計成原電池,則電池的負極材料應選擇;正極的電極反應式為。
(2)工業上常用電解氧化法在鋁制品表面形成致密、耐腐蝕的氧化膜,電解質一般采用硫酸溶液,陽極的電極反應式為。
Ⅱ.一種以液態肼(N2H4)為燃料的電池裝置如圖甲所示,該電池用KOH溶液作為電解質溶液。以該燃料電池作為電源電解足量的飽和CuSO4溶液以實現向鐵棒上鍍銅,裝置如圖乙所示。
(3)a電極為燃料電池的極(填“正”或“負”),其電極反應方程式為。
(4)d電極應選用的電極材料為。(填“鐵”或“銅”)
Ⅲ.氰化物在工業中廣泛存在于電鍍、油漆、染料、橡膠等行業中,但是氰化物有劇毒,很多氰化物在加熱或與酸作用后會釋放出揮發性的有毒氣體氰化氫。因此在含氰工業廢水排放前,需要對其進行治理。在堿性條件下利用電解法除去廢水中的氯化物(以CN-代表),裝置如圖丙,已知石墨電極上依次發生的部分反應有:
a.CN-+2OH--2e -=CNO-+H2O
b.2Cl--2e-=Cl2↑
c.3Cl2+2CNO -+8OH-=N2↑+6Cl-+2CO32-+4H2O
(5)鐵電極上發生的電極反應為。
(6)該電解過程一般控制pH在9~10之間,pH偏高或偏低均會引起除氰效果降低,你認為可能的原因是。忽略鐵電極上的其他反應,電解一段時間后,相同條件下在石墨電極處測得產生N2xmL,同時在鐵電極處產生氣體ymL,則氰去除率為。(氰去除率=100%)實際CN-去除量理論CN-去除量×組卷:42引用:2難度:0.5 -
22.常溫下,在二元弱酸H2C2O4(草酸)溶液中滴加NaOH溶液,所得混合溶液的pH與溶液中離子濃度比的對數值的關系分別如圖所示。

(1)寫出H2C2O4的電離方程式:。
(2)lg與pH關系是曲線c(HC2O4-)c(H2C2O4)(填“M”或“N”)。
(3)寫出e點時溶液中發生的主要離子反應方程式。
(4)NaHC2O4溶液顯(填“酸”或“堿”)性,請用數據說明:。
(5)已知:難溶物Ag2C2O4的Ksp=5.0×10-12,在0.001mol/L10mL的Na2C2O4溶液中加入等體積、濃度至少為mol/L的AgNO3溶液時才能生成沉淀。
(6)查閱資料,草酸可與酸性高錳酸鉀發生如下反應:+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。可利用酸性高錳酸鉀標準溶液滴定草酸并測取草酸溶液的濃度,滴定達到終點時現象為MnO-4。用0.1000mol/L酸性高錳酸鉀標準溶液滴定10.00mL草酸溶液時,消耗標準液的體積如下表。通過計算可知c(H2C2O4)=mol/L。若滴定時所用的酸性高錳酸鉀溶液因久置導致濃度變小,則由此測得的c(H2C2O4)會(填“偏大”、“偏小”或“不變”)。初讀數V0(mL) 末讀數V1(mL) 第一次 1.00 11.10 第二次 1.50 15.30 第三次 2.20 12.10 組卷:24引用:2難度:0.7


