資源化利用CO2,不僅可以減少溫室氣體的排放,還可以獲得燃料或重要的化工產品。回答下列問題。
(1)理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示:計算可得HCN(g)?HNC(g)ΔH=+59.3+59.3kJ/mol。HCN與HNC穩定性較強的是 HCNHCN。
(2)聚合離子液體是目前廣泛研究的CO2吸附劑。結合如圖分析聚合離子液體吸附CO2的有利條件是 2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-12NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-1。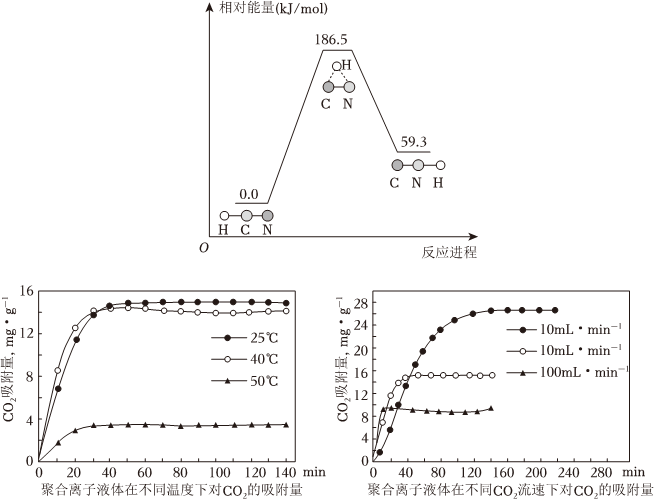
(3)生產尿素:
工業上以CO2、NH3為原料生產尿素[CO(NH2)2],該反應分為二步進行:
第一步:2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ?mol-1
第二步:H2NCOONH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ?mol-1
①寫出上述合成尿素的熱化學方程式 2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-12NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-1。
②某實驗小組模擬工業上合成尿素,在一定體積的密閉容器中投入4molNH3和1molCO2,實驗測得反應中各組分物質的量隨時間的變化如圖所示:
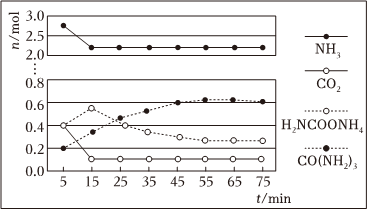
已知總反應的快慢由慢的一步反應決定,則合成尿素總反應的快慢由第 二二步反應決定,總反應進行到 5555min時到達平衡。
(4)合成乙酸:
中國科學家首次以CH3OH、CO2和H2為原料高效合成乙酸,其反應路徑如圖所示:
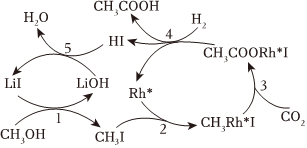
①原料中的CH3OH可通過電解法由CO2制取,用稀硫酸作電解質溶液,寫出生成CH3OH的電極反應式 CO2+6e-+6H+=CH3OH+H2OCO2+6e-+6H+=CH3OH+H2O。
②根據圖示,寫出總反應的化學方程式 CH3OH+CO2+H2 催化劑 CH3COOH+H2OCH3OH+CO2+H2 催化劑 CH3COOH+H2O。
催化劑
催化劑
【答案】+59.3;HCN;2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-1;2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-43kJ?mol-1;二;55;CO2+6e-+6H+=CH3OH+H2O;CH3OH+CO2+H2 CH3COOH+H2O
催化劑
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:19引用:1難度:0.6
相似題
-
1.肼(N2H4)可作為發射火箭的燃料。已知1g液態肼(N2H4)氣體在空氣中燃燒生成氮氣和水蒸氣,放出16.7kJ的熱量,該反應的熱化學方程式是( )
A.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-16.7kJ?mol-1 B.N2H4(l)+O2(g)═2H2O(l)+N2(g),△H=-534.4kJ?mol-1 C.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-534.4kJ?mol-1 D.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=+534.4kJ?mol-1 發布:2024/12/30 3:0:4組卷:121引用:9難度:0.6 -
2.氫在地球上主要以化合態的形式存在,是宇宙中分布最廣泛的物質,它構成了宇宙質量的75%,屬于二次能源.工業上生產氫的方式很多,常見的有水電解制氫,煤炭氣化制氫,重油及天然氣水蒸氣催化制氫等.氫氣是一種理想的綠色能源,如圖1為氫能產生和利用的途徑:
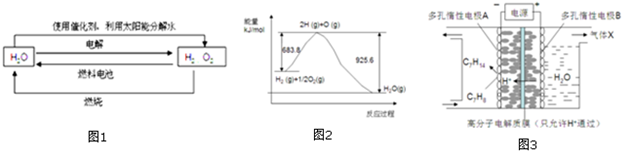
(1)圖1的四個過程中能量轉化形式有
A.2種 B.3種 C.4種 D.4種以上
(2)電解過程要消耗大量的電能,而使用微生物作催化劑在陽光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通電2H2(g)+O2(g)△H2光照催化劑
以上反應的△H1△H2(選填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依據圖2能量變化寫出氫氣燃燒生產液態水的熱化學方程式
(4)氫能利用需要選擇合適的儲氫材料.
①NaBH4是一種重要的儲氫載體,能與水反應生成NaBO2,且反應前后B的化合價不變,該反應的化學方程式為
②鑭鎳合金在一定條件下可吸收氫氣生產氫化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)釋放出氣態氫,根據平衡移動的原理,可改變的條件之一是
③一定條件下,如圖3所示裝置可實現有機物的電化學儲氫,使C7H8轉化為C7H14,則電解過程中產生的氣體X 為,電極A上發生的電極反應式為.發布:2024/12/17 8:0:2組卷:38引用:1難度:0.5 -
3.在298K、1.01×105Pa下,將0.5mol CO2通入750mL 1mol?L-1NaOH溶液中充分反應,測得反應放出xkJ的熱量。已知在該條件下,1mol CO2通入1L 2mol?L-1NaOH溶液中充分反應放出ykJ的熱量,則CO2與NaOH溶液反應生成NaHCO3的熱化學方程式正確的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2y-x)kJ?mol-1 B.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2x-y)kJ?mol-1 C.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(4x-y)kJ?mol-1 D.2CO2(g)+2NaOH(l)═2NaHCO3(l)ΔH=-(8x-2y)kJ?mol-1 發布:2024/12/30 4:0:1組卷:142引用:5難度:0.7


