2022-2023學年福建省福州市八縣(市、區)一中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題3分,共45分。每小題只有一項符合題目要求)
-
1.人類將在未來逐漸由“碳素燃料文明時代”過渡至“太陽能文明時代”(包括風能、生物質能等太陽能轉換形態),屆時人們將適應“低碳經濟”和“低碳生活”。下列說法錯誤的是( )
A.煤、石油和天然氣都屬于碳素燃料 B.發展太陽能經濟有助于減緩溫室效應 C.太陽能電池可將太陽能直接轉化為電能 D.目前研究菠菜蛋白質“發電”不屬于“太陽能文明” 組卷:168引用:12難度:0.8 -
2.化學與生產、生活、科技等密切相關。下列說法不正確的是( )
A.除去CuCl2溶液中少量的FeCl3,可選用CuO固體 B.Sb2O3可用作白色顏料和阻燃劑等,在實驗室中可用SbCl3的水解反應制取 C.處理鍋爐水垢中的硫酸鈣,可以先用飽和碳酸鈉溶液浸泡,再用酸除去 D.氯堿工業中使用陽離子交換膜,主要目的是使電解池中形成閉合回路 組卷:34引用:4難度:0.7 -
3.下列各組離子在指定溶液中一定能大量共存的是( )
A.滴入甲基橙顯紅色的溶液:K+、Na+、CO32-、NO3- B.室溫下,水電離的c(OH-)=1×10-13mol/L的溶液:Na+、HCO3-、Br-、Ba2+ C.室溫下,pH=5的溶液:NO3-、Cl-、Fe3+、SO42- D.室溫下, =1012的溶液:Fe2+、Al3+、SO42-、I-c(H+)c(OH-)組卷:44引用:2難度:0.7 -
4.下列事實不能用夏勒特列原理解釋的是( )
A.用FeCl3晶體配制溶液時,先將其溶于較濃鹽酸中 B.紅棕色的NO2氣體,加壓后顏色先變深后變淺 C.合成氨工業中使用鐵觸媒作催化劑 D.對熟石灰的懸濁液加熱,懸濁液中固體質量增加 組卷:43引用:2難度:0.8 -
5.熱激活電池可用作火箭、導彈的工作電源。一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl-KCl混合物受熱熔融后,電池即可瞬間輸出電能。該電池總反應為PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb。下列有關說法正確的是( )
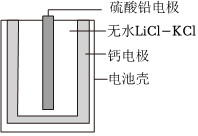
A.正極反應式:Ca+2Cl--2e-═CaCl2 B.放電過程中,Li+向正極移動 C.常溫時,在正極與負極間接上電流表,指針偏轉 D.每轉移0.1mol電子,理論上生成20.7gPb 組卷:32引用:2難度:0.7 -
6.沿海電廠采用海水為冷卻水,但在排水管中生物的附著和滋生會阻礙冷卻水排放并降低冷卻效率。為解決這一問題,通常在管道口設置一對惰性電極 (如圖所示),通入一定的電流。下列敘述錯誤的是( )
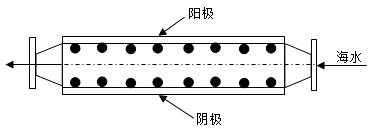
A.陽極發生將海水中的Cl-氧化生成Cl2的反應 B.管道中可以生成氧化滅殺附著生物的NaClO C.陰極生成的H2應及時通風稀釋安全地排入大氣 D.陽極表面形成的Mg(OH)2等積垢需要定期清理 組卷:1280引用:19難度:0.7
二、非選擇題(共4題,共55分)
-
18.資源化利用CO2,不僅可以減少溫室氣體的排放,還可以獲得燃料或重要的化工產品。回答下列問題。
(1)理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示:計算可得HCN(g)?HNC(g)ΔH=kJ/mol。HCN與HNC穩定性較強的是。
(2)聚合離子液體是目前廣泛研究的CO2吸附劑。結合如圖分析聚合離子液體吸附CO2的有利條件是。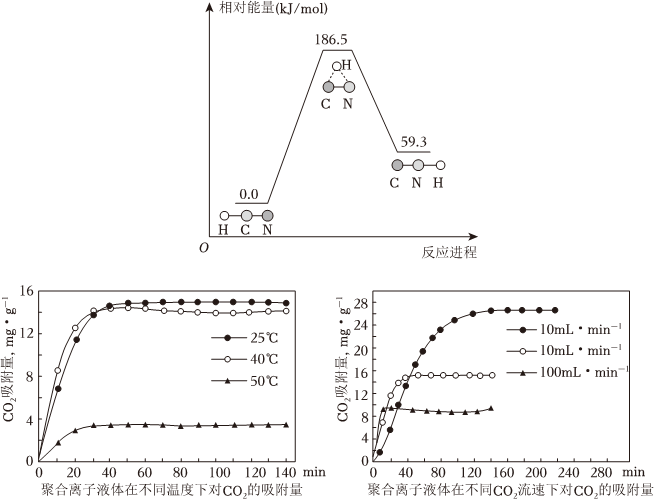
(3)生產尿素:
工業上以CO2、NH3為原料生產尿素[CO(NH2)2],該反應分為二步進行:
第一步:2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ?mol-1
第二步:H2NCOONH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ?mol-1
①寫出上述合成尿素的熱化學方程式。
②某實驗小組模擬工業上合成尿素,在一定體積的密閉容器中投入4molNH3和1molCO2,實驗測得反應中各組分物質的量隨時間的變化如圖所示: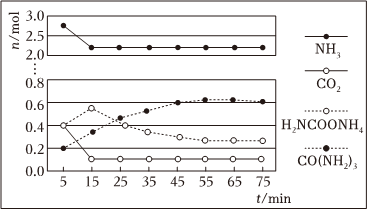
已知總反應的快慢由慢的一步反應決定,則合成尿素總反應的快慢由第步反應決定,總反應進行到min時到達平衡。
(4)合成乙酸:
中國科學家首次以CH3OH、CO2和H2為原料高效合成乙酸,其反應路徑如圖所示: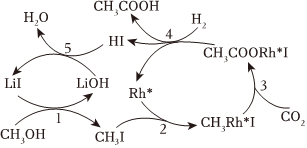
①原料中的CH3OH可通過電解法由CO2制取,用稀硫酸作電解質溶液,寫出生成CH3OH的電極反應式。
②根據圖示,寫出總反應的化學方程式。組卷:19引用:1難度:0.6 -
19.菱錳礦主要成分為MnCO3、SiO2、CaMg(SiO3)2和少量FeCO3,一種利用該礦石制取高純二氧化錳的工藝流程如圖所示:
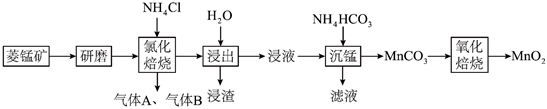
已知:常溫下,H2CO3的Kal=4.5×10-7,Ka2=4.7×10-11;Ksp(MnCO3)=2.24×10-11。回答下列問題:
(1)“研磨”的目的是。
(2)“浸出”后浸渣的主要成分有Fe2O3、CaMg(SiO3)2、(填化學式,下同)。將“氯化焙燒”得到的氣體A通入水中,再通入氣體B,可制得“沉錳”時需要的試劑NH4HCO3,則氣體A、B分別為、CO2。
(3)已知“沉錳”時有CO2生成,寫出“沉錳”時反應的離子反應方程式:。
(4)若“沉錳”后所得濾液中c(Mn2+)=10-5mol?L-1、pH=6,此時溶液中c()=HCO-3mol?L-1(保留2位有效數字);“沉錳”后通過過濾、洗滌、干燥得到MnCO3,檢驗沉淀洗滌干凈的方法是。
(5)寫出空氣中進行“氧化焙燒”反應的化學方程式:。組卷:26引用:3難度:0.6


