海洋資源的利用具有非常廣闊的前景。
利用空氣吹出法從海水(弱堿性)中提取溴的流程如圖。

已知:溴單質的沸點為58.5℃
(1)溴元素在元素周期表中的位置是 第四周期第ⅦA族第四周期第ⅦA族。
(2)“吸收塔”中發生反應的離子方程式為 Br2+SO2+2H2O=4H++2Br-+SO2-4Br2+SO2+2H2O=4H++2Br-+SO2-4。
(3)“蒸餾塔”中溫度應控制在 BB(填序號)。
A.40~50℃
B.70~80℃
C.100℃以上
(4)物質A HClHCl(填化學式)可以循環利用,降低成本。
(5)探究“氧化”的適宜條件,測得不同條件下溶液中被氧化的Br的百分含量如圖:

注:n(Cl)n(Br)表示加入氯元素與海水中溴元素物質的量之比。
①“氧化”的適宜條件為 pH=1,n(Cl)n(Br)=1.1pH=1,n(Cl)n(Br)=1.1。
②已知:海水中溴的濃度是64mg/L,經該方法處理后1m3海水最終得到38.4gBr2,則溴的總提取率為 60%60%。
③吸收后的空氣進行循環利用。吹出時,Br2吹出率與吸收塔中SO2流量的關系如圖所示。SO2流量過大,Br2吹出率反而下降的原因是:過量的二氧化硫隨“吸收Br2后的空氣”進入“吹出”步驟,與溴反應,使溴吹出率下降,反應方程式為:SO2+Br2+2H2O=2HBr+H2SO4過量的二氧化硫隨“吸收Br2后的空氣”進入“吹出”步驟,與溴反應,使溴吹出率下降,反應方程式為:SO2+Br2+2H2O=2HBr+H2SO4。

Ⅱ.離子交換法從海帶中提取碘是一種較為先進的制碘工藝。下圖是使用離子交換樹脂的“離子交換法”從海帶中提取碘的主要流程。

已知:
①I2+I-?I-3;
②強堿性陰離子樹脂(用R-Cl表示,Cl可被其它更易被吸附的陰離子替代)對多碘離子(I-3)有很強的交換吸附能力;
③步驟“交換吸附”發生的反應:R-Cl+I-3=R-I3+Cl-。
試回答下列問題:
(1)下列各步反應中,屬于氧化還原反應的有:BCBC(填序號)。
A.交換吸附
B.洗脫
C.酸化
D.NaCl洗脫
(2)酸性條件下,原料被H2O2氧化時發生的反應有:
①2I-+H2O2+2H+=I2+2H2O2I-+H2O2+2H+=I2+2H2O;
②I2+I-?I-3。
(3)實驗室模擬步驟“酸化氧化”,一般選用氯水。工業上生產企業可以按照自己的實際情況,選擇合適的氧化劑。若某企業在酸性條件下選擇NaNO2為氧化劑,反應生成一種無色氣體,遇空氣立即變為紅棕色,則添加氧化劑與NaI的質量比應不少于 23:5023:50。
SO
2
-
4
SO
2
-
4
n
(
C
l
)
n
(
B
r
)
n
(
C
l
)
n
(
B
r
)
n
(
C
l
)
n
(
B
r
)
I
-
3
I
-
3
I
-
3
I
-
3
【考點】從海水中提取溴.
【答案】第四周期第ⅦA族;Br2+SO2+2H2O=4H++2Br-+;B;HCl;pH=1,=1.1;60%;過量的二氧化硫隨“吸收Br2后的空氣”進入“吹出”步驟,與溴反應,使溴吹出率下降,反應方程式為:SO2+Br2+2H2O=2HBr+H2SO4;BC;2I-+H2O2+2H+=I2+2H2O;23:50
SO
2
-
4
n
(
C
l
)
n
(
B
r
)
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:29引用:1難度:0.5
相似題
-
1.海洋中有豐富的食品、礦產、能源、藥物和水產資源,下圖為海水利用的部分過程。下列有關說法不正確的是( )
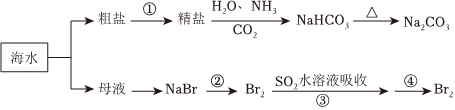
A.制取NaHCO3的反應是利用其溶解度小于NaCl B.侯氏制堿應先通NH3再通CO2 C.在第②、③、④步驟中,溴元素均被氧化 D.③④的目的是進行溴的富集 發布:2024/12/30 3:30:1組卷:129引用:9難度:0.6 -
2.海水是化學元素的寶庫,從海水中可以提取或生產多種化工原料,如食鹽、氯氣、單質溴、鎂、純堿等,它們在工農業生產中有著廣泛的用途.根據學過的知識回答下列問題:
(1)某化學興趣小組計劃用氯氣和氫氧化鈉制取簡易消毒液.
①其反應原理為:(用離子方程式表示).
②配制250mL 4.0mol?L-1NaOH溶液,需要用到的玻璃儀器,除燒杯、玻璃棒外,還必須用到的是.
(2)工業制得粗硅后,再與氯氣等物質發生反應,最終得到純硅.請寫出工業制取粗硅的化學方程式:
(3)金屬鎂被譽為“國防金屬”,若鎂起火,不能用CO2來滅火,其原因可用化學方程式表示為
(4)①若Na2CO3固體中混有少量NaHCO3雜質,除去雜質的方法是,
②若NaHCO3溶液中混有少量Na2CO3雜質,除去雜質的方法是.發布:2024/10/27 17:0:2組卷:11引用:1難度:0.5 -
3.海水資源開發利用的部分過程如圖所示:
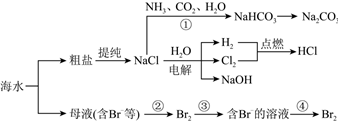
下列說法正確的是( )A.粗鹽(含Mg2+、Ca2+、 等)提純所加試劑順序為NaOH→Na2CO3→BaCl2→過濾→HClSO2-4B.過程①為了提高產率一般先通CO2再通NH3 C.用澄清石灰水可以鑒別NaHCO3和Na2CO3溶液 D.過程②③④可以達到富集溴的目的 發布:2024/11/3 6:0:1組卷:50引用:3難度:0.7


