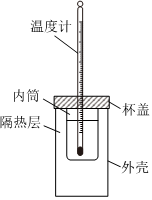
 反應熱的數值可以通過理論計算得出,也可以通過實驗測得。某實驗探究小組用0.50mol?L-1的NaOH溶液和0.50mol?L-1的硫酸溶液進行中和反應的反應熱的測定。
反應熱的數值可以通過理論計算得出,也可以通過實驗測得。某實驗探究小組用0.50mol?L-1的NaOH溶液和0.50mol?L-1的硫酸溶液進行中和反應的反應熱的測定。
(1)若實驗中需要使用250 mL NaOH溶液,則在配制時應稱量NaOH固體 5.05.0g。
(2)從實驗裝置上看,還缺少 玻璃攪拌器玻璃攪拌器,裝置中隔熱層的作用是 減少實驗過程中的熱量損失減少實驗過程中的熱量損失。利用上述NaOH溶液和硫酸溶液反應測定中和反應的反應熱的實驗裝置如圖所示。
(3)取50mLNaOH溶液和30mL硫酸溶液進行實驗,實驗數據如表:
|
實驗次數 |
起始溫度t1/℃ |
最高溫度t2/℃ |
||
| 硫酸溶液 | NaOH溶液 | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.5 |
| 2 | 25.9 | 25.9 | 25.9 | 30.5 |
| 3 | 26.0 | 26.2 | 26.1 | 32 |
60.2kJ/mol
60.2kJ/mol
(計算結果精確到小數點后一位)。若用30mL1mol/L醋酸代替H2SO4溶液進行上述實驗,測得反應后的ΔH 偏大
偏大
(填“偏大”“偏小”或“不受影響”)。②上述實驗結果與理論值(-57.3kJ?mol-1)有偏差,產生偏差的原因不可能是
ACD
ACD
(填序號)。A.實驗裝置保溫、隔熱效果差
B.用溫度計測量最高溫度時俯視讀數
C.用溫度計測定過NaOH溶液的起始溫度后,直接測定硫酸溶液的溫度
D.把NaOH溶液分多次倒入盛有硫酸溶液的小燒杯中
【答案】5.0;玻璃攪拌器;減少實驗過程中的熱量損失;60.2kJ/mol;偏大;ACD
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:12引用:4難度:0.7
相似題
-
1.下列關于中和反應的反應熱測定實驗的說法正確的是( )
A.小燒杯內殘留水,會使測得的反應熱數值偏小 B.酸、堿混合時,應把量筒中的溶液緩緩倒入燒杯的溶液中,以防液體外濺 C.燒杯間填滿碎紙條的作用是固定小燒杯 D.可用相同濃度和體積的氨水代替稀氫氧化鈉溶液進行實驗 發布:2024/12/14 13:30:1組卷:37引用:3難度:0.7 -
2.已知:25℃、101kPa時,H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。分別使用3組稀溶液來測定中和反應的反應熱,下列說法正確的是( )
序號 ① ② ③ 稀溶液 硫酸和氫氧化鈉 硫酸和氨水 硫酸和氫氧化鋇 ΔH/(kJ?mol-1) a b c A.b<a<c B.生成的水越多,中和反應的反應熱越小 C.酸堿混合要迅速,否則熱量容易散失 D.實驗中的玻璃攪拌器可換成鐵制攪拌器 發布:2024/10/10 0:0:4組卷:34引用:4難度:0.7 -
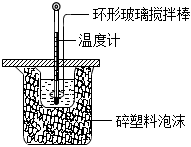 3.中和熱測定實驗中,用50mL0.50mol?L-1鹽酸和50mL0.55mol?L-1NaOH進行實驗,下列說法不正確的是( )
3.中和熱測定實驗中,用50mL0.50mol?L-1鹽酸和50mL0.55mol?L-1NaOH進行實驗,下列說法不正確的是( )A.改用60 mL0.50 mol?L-1鹽酸跟50 mL0.55 mol?L-1NaOH溶液進行反應,求出的中和熱數值和原來相同 B.測定過程中溫度計至少用到3次,測量混合后的溶液溫度時,應記錄反應后的最高溫度 C.酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用環形玻璃攪拌棒攪拌 D.裝置中的大小燒杯之間填滿碎泡沫塑料的作用是保溫隔熱、減少熱量損失 發布:2024/12/3 9:0:2組卷:52引用:2難度:0.7


