研究金屬腐蝕和防腐的原理很有現實意義。
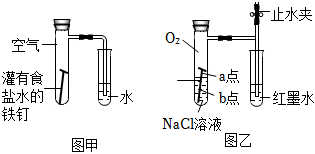
(1)甲圖為人教版教材中探究鋼鐵的吸氧腐蝕的裝置。某興趣小組按該裝置實驗,導管中液柱的上升緩慢,下列措施可以更快更清晰觀察到水柱上升現象的有 ACDACD(填序號)
A.用純氧氣代替試管內空氣
B.用酒精燈加熱試管提高溫度
C.將鐵釘換成鐵粉和炭粉混合粉末
D.換成更細的導管,水中滴加紅墨水
(2)該小組將甲圖裝置改進成乙圖裝置并進行實驗,導管中紅墨水液柱高度隨時間的變化如下表,根據數據判斷腐蝕的速率隨時間逐漸 減慢減慢(填“加快”、“不變”、“減慢”),你認為影響因素為 氧氣的濃度氧氣的濃度。
| 時間/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
| 實驗操作 | 實驗現象 | 實驗結論 |
| 向NaCl溶液中滴加2~3滴酚酞指示劑 | a點附近溶液出現紅色 | a點電極反應為① O2+4e-+2H2O=4OH- O2+4e-+2H2O=4OH- |
| 然后再滴加2~3滴② 鐵氰化鉀 鐵氰化鉀 |
b點周圍出現藍色沉淀 | b點電極反應為③ Fe-2e-═Fe2+ Fe-2e-═Fe2+ |
負
負
極。而對于地下輸水鋼管,經常使用“犧牲陽極法”進行保護,鋼鐵承擔的電極是 正
正
極。金屬陽極鈍化也是電化學防腐方法之一,將Fe作陽極置于H2SO4溶液中,一定條件下Fe鈍化形成致密Fe3O4氧化膜,試寫出該陽極電極反應式 3Fe-8e-+4H2O=Fe3O4+8H+
3Fe-8e-+4H2O=Fe3O4+8H+
。【考點】吸氧腐蝕與析氫腐蝕.
【答案】ACD;減慢;氧氣的濃度;O2+4e-+2H2O=4OH-;鐵氰化鉀;Fe-2e-═Fe2+;負;正;3Fe-8e-+4H2O=Fe3O4+8H+
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:141引用:2難度:0.6
相似題
-
1.《我在故宮修文物》展示了專家精湛的技藝和對傳統文化的熱愛與堅守,也令人體會到化學方法在文物保護中的巨大作用。某博物館修復出土鐵器的過程如下。
(1)檢測銹蝕產物
鐵器在具有O2、主要成分的化學式 Fe3O4 Fe2O3?H2O FeO(OH) FeOCl 等環境中容易被腐蝕。
(2)分析腐蝕原理:一般認為,鐵經過了如下腐蝕循環。
Ⅰ.Fe轉化為Fe2+。
Ⅱ.Fe2+在自然環境中形成FeO(OH),該物質中鐵元素的化合價為。
Ⅲ.FeO(OH)和Fe2+反應形成致密的Fe3O4保護層,Fe2+的作用是。
a.氧化劑
b.還原劑
c.既不是氧化劑也不是還原劑
Ⅳ.Fe3O4保護層被氧化為FeO(OH),如此往復腐蝕。Fe3O4+O2+H2O═FeO(OH)(將反應補充完整)
(3)研究發現,Cl-對鐵的腐蝕會造成嚴重影響。化學修復:脫氯、還原,形成Fe3O4保護層,方法如下:
將鐵器浸沒在盛有0.5mol/L Na2SO3、0.5mol/L NaOH溶液的容器中,緩慢加熱至60~90℃.一段時間,取出器物,用NaOH溶液洗滌至無Cl-。
①檢測洗滌液中無Cl-的方法是。
②脫氯反應:FeOCl+OH-═FeO(OH)+Cl-.離子反應的本質是離子濃度的減小,FeOCl與FeO(OH)的溶解度更小的是。
③Na2SO3還原FeO(OH)形成Fe3O4的離子方程式是。發布:2024/6/27 10:35:59組卷:116引用:2難度:0.6 -
2.某小組同學對鐵的腐蝕與保護進行如下探究設計。請回答下列問題
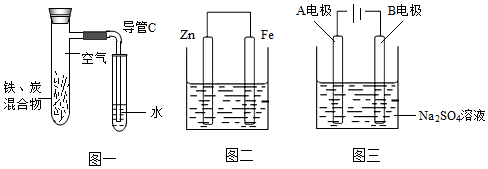
(1)將鐵粉和活性炭的混合物用NaCl溶液潤濕后,至于圖一所示裝置中將導管c中液柱逐漸上升至高于試管b中液面,其原因是試管a中發生了腐蝕化學方程式表示其變化,試管a外壁逐漸變熱,推測后續導管c液柱可能會逐漸。
(2)學生甲用圖一裝置只將“NaCl溶液”改為“稀醋酸”潤濕,此時碳粉電極反應式為,此時可觀察到的現象為。
(3)學生乙用圖二裝置驗證犧牲陽極的陰極保護法的效果,燒杯內盛有(3%NaCl溶液),當連接好的裝置一段時間后,直接向鐵及附近滴入K3[Fe(CN)6]溶液,發現溶液中有特征藍色沉淀產生,于是得出結論,此裝置不能有效保護鐵電極。
①你對此評論為(填“合理”或“不合理”),請用必要的文字和化學用語進行分析。
②當實驗方案為時,觀察不到明顯現象,得出結論:該裝置能有效保護鐵。
(4)學生丙用圖三裝置對鐵電極進行外加電流的陰極保護實驗,A電極反應式為,B電極材料是。發布:2024/6/27 10:35:59組卷:26引用:1難度:0.6 -
3.某化學研究小組創新設計了鐵的生銹實驗,并對鐵銹成分進行測定.實驗1:鐵的快速生銹先在如圖1玻璃管中注滿飽和食鹽水,一段時間后排凈食鹽水.打開圖1下端止水夾,5min左右就可看到紅墨水開始緩慢上升,40min左右就能明顯地觀察到鐵絲網表面有鐵銹生成.
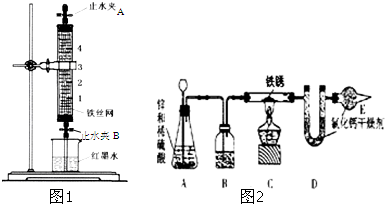
(1)排出圖1玻璃管中食鹽水的操作為.
(2)用圖1裝置進行實驗,觀察到紅墨水上升到刻度“1”的位置,由此可得出的一個結論是.
(3)現要探究食鹽水濃度和鐵生銹速率的關系.請簡述你所設計的實驗方案:.
實驗2:鐵銹成分的測定為確定鐵銹成分(Fe2O3?xH2O)中的x值,稱取鐵銹a g,進行如下實驗.
方案1:利用圖2裝置進行實驗
(4)點燃酒精燈之前,必須進行的實驗操作是.
(5)從安全角度考慮,圖2裝置的明顯缺陷是.
(6)為達到實驗目的,實驗中要測定的數據是.
方案2:將鐵銹溶于過量稀硫酸,向所得溶液中滴加b mol?L-1KI溶液至剛好反應,3次實驗平均消耗該KI溶液V mL.
(7)實驗中應選用的指示劑是.
(8)測得鐵銹中x值為.發布:2024/10/27 17:0:2組卷:96引用:1難度:0.1


