2021-2022學(xué)年天津市南開中學(xué)高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有1個正確選項,每小題3分,共54分)
-
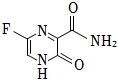 1.法匹拉韋是治療新冠肺炎的一種藥物,結(jié)構(gòu)簡式如圖,下列說法錯誤的是( )
1.法匹拉韋是治療新冠肺炎的一種藥物,結(jié)構(gòu)簡式如圖,下列說法錯誤的是( )A.該分子中N、O、F的第一電離能由大到小的順序為F>N>O B.該分子中σ鍵與π鍵數(shù)目相等 C.該分子中F原子的最高能層符號為L D.該分子中C=C鍵的鍵能大于C-C鍵的鍵能 組卷:127引用:3難度:0.7 -
2.下列說法不正確的是( )
A.原電池中發(fā)生的可逆反應(yīng)達到平衡時,該電池仍有電流產(chǎn)生 B.在原電池的負(fù)極和電解池的陽極上發(fā)生的都是失電子的氧化反應(yīng) C.普通鋅錳電池與堿性鋅錳電池的比能量不同 D.燃料電池中通入氧氣的一極為正極 組卷:89引用:3難度:0.6 -
3.某學(xué)生欲完成2HCl+2Ag═2AgCl↓+H2↑反應(yīng),設(shè)計了下列四個實驗,你認(rèn)為可行的實驗是( )
A. 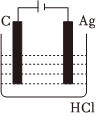
B. 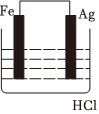
C. 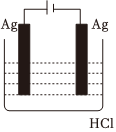
D. 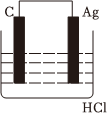 組卷:94引用:27難度:0.7
組卷:94引用:27難度:0.7 -
4.下列說法正確的是( )
A.2px、2py、2pz軌道相互垂直,能量不等 B.元素周期表各周期總是從ns能級開始,以np能級結(jié)束 C.電負(fù)性越大,元素的非金屬性越強,第一電離能也越大 D.d區(qū)、ds區(qū)全部是金屬元素 組卷:27引用:2難度:0.8 -
5.下列有關(guān)說法正確的是( )
A.電解法精煉銅時,以粗銅作陰極,純銅作陽極 B.一定溫度下向恒容密閉容器中充入SO2和O2,當(dāng)反應(yīng)到達平衡時,容器中SO2、O2、SO3的物質(zhì)的量之比一定為2:1:2 C.常溫下,向NH4Cl溶液中加入少量濃鹽酸,溶液中 的值增大c(H+)c(NH4+)D.反應(yīng)N2(g)+3H2(g)?2NH3(g)的ΔH可通過下式估算:ΔH=產(chǎn)物的鍵能之和-反應(yīng)物的鍵能之和 組卷:68引用:1難度:0.7 -
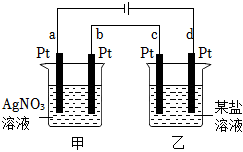 6.如圖所示的裝置,通電一段時間后,測得甲池中某電極質(zhì)量增加,乙池中某電極上析出某金屬。下列說法正確的是( )
6.如圖所示的裝置,通電一段時間后,測得甲池中某電極質(zhì)量增加,乙池中某電極上析出某金屬。下列說法正確的是( )A.某鹽溶液可能是CuSO4溶液 B.某鹽溶液可能是Mg(NO3)2溶液 C.甲池中b電極上析出金屬銀 D.乙池中d電極上析出某金屬 組卷:78引用:1難度:0.7
二、填空題
-
19.A、B、C、D、E、F、G是元素周期表前四周期常見元素,且原子序數(shù)依次增大,其相關(guān)信息如表所示,請用化學(xué)用語回答下列問題。
(1)寫出元素符號A:A 原子核外有6種不同運動狀態(tài)的電子 C 基態(tài)原子中s電子總數(shù)與p電子總數(shù)相等 D 原子半徑在同周期元素中最大 E 基態(tài)原子最外層電子排布式為3s23p1 F 基態(tài)原子的最外層p軌道有2個電子的自旋狀態(tài)與其他電子的自旋狀態(tài)相反 G 生活中使用最多的一種金屬 B:G,寫出元素B的基態(tài)原子的軌道表示式:。
(2)C、D、E三種元素的原子半徑由大到小的順序。
(3)由A、B、C三種元素分別與氫元素形成的簡單氣態(tài)氫化物,其空間構(gòu)型分別為:,,,其中C的簡單氣態(tài)氫化物的鍵角為:。
(4)已知元素A、B形成的(AB)2鏈狀分子中所有原子都滿足8電子穩(wěn)定結(jié)構(gòu),則其分子中σ鍵與π鍵之比為。
(5)F元素的簡單陰離子結(jié)構(gòu)示意圖。電解D與F形成的化合物的水溶液在工業(yè)上有著重要應(yīng)用,試寫出其電解的總的化學(xué)反應(yīng)方程式:。
(6)元素G位于周期表的區(qū),其價電子的排布式為:,該元素可形成G2+、G3+,其中較穩(wěn)定的是G3+,原因是。
(7)短周期元素M與元素E在周期表中的位置呈現(xiàn)對角線關(guān)系,已知元素M、F的電負(fù)性分別為1.5和3.0,預(yù)測它們形成的化合物是化合物(填“離子”或“共價”)推測M的最高價氧化物對應(yīng)水化物(填“能”或“不能”)與D的最高價氧化物對應(yīng)水化物發(fā)生反應(yīng)。組卷:145引用:1難度:0.5 -
20.研究金屬腐蝕和防腐的原理很有現(xiàn)實意義。
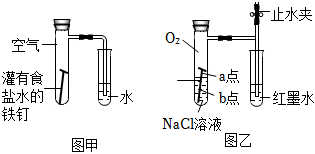
(1)甲圖為人教版教材中探究鋼鐵的吸氧腐蝕的裝置。某興趣小組按該裝置實驗,導(dǎo)管中液柱的上升緩慢,下列措施可以更快更清晰觀察到水柱上升現(xiàn)象的有(填序號)
A.用純氧氣代替試管內(nèi)空氣
B.用酒精燈加熱試管提高溫度
C.將鐵釘換成鐵粉和炭粉混合粉末
D.換成更細(xì)的導(dǎo)管,水中滴加紅墨水
(2)該小組將甲圖裝置改進成乙圖裝置并進行實驗,導(dǎo)管中紅墨水液柱高度隨時間的變化如下表,根據(jù)數(shù)據(jù)判斷腐蝕的速率隨時間逐漸(填“加快”、“不變”、“減慢”),你認(rèn)為影響因素為。
(3)為探究鐵釘腐蝕實驗a、b兩點發(fā)生的反應(yīng),進行以下實驗,請完成表格空白:時間/min 1 3 5 7 9 液柱高度/cm 0.8 2.1 3.0 3.7 4.2
(4)為防止鋼鐵被腐蝕,很多鋼鐵部件采用在表面電鍍一層鋅或鎳的方法,電鍍時鋼鐵部件需連接電源的實驗操作 實驗現(xiàn)象 實驗結(jié)論 向NaCl溶液中滴加2~3滴酚酞指示劑 a點附近溶液出現(xiàn)紅色 a點電極反應(yīng)為① 然后再滴加2~3滴② b點周圍出現(xiàn)藍(lán)色沉淀 b點電極反應(yīng)為③ 極。而對于地下輸水鋼管,經(jīng)常使用“犧牲陽極法”進行保護,鋼鐵承擔(dān)的電極是極。金屬陽極鈍化也是電化學(xué)防腐方法之一,將Fe作陽極置于H2SO4溶液中,一定條件下Fe鈍化形成致密Fe3O4氧化膜,試寫出該陽極電極反應(yīng)式。組卷:141引用:2難度:0.6


