用圖1的實驗裝置模擬工業(yè)上用電解飽和食鹽水的產(chǎn)物制備鹽酸的工藝。

(1)電解飽和食鹽水的化學(xué)方程式為 2NaCl+2H2O 電解 2NaOH+H2↑+Cl2↑2NaCl+2H2O 電解 2NaOH+H2↑+Cl2↑。倒置的漏斗的作用是 便于氯化氫氣體被水吸收,防止氣體擴(kuò)散到空氣中便于氯化氫氣體被水吸收,防止氣體擴(kuò)散到空氣中。實驗時漏斗中觀察到的現(xiàn)象是 蒼白色火焰,且產(chǎn)生白霧蒼白色火焰,且產(chǎn)生白霧。
(2)實驗過程中,B極連接電源的 正極正極(填寫電源電極名稱),理由是 外管中為H2,內(nèi)管中為Cl2,所以B極產(chǎn)生氯氣,為陽極,陽極與電源的正極相連外管中為H2,內(nèi)管中為Cl2,所以B極產(chǎn)生氯氣,為陽極,陽極與電源的正極相連。
(3)實驗后U形管中得到的NaOH溶液中還混有少量NaCl(兩種物質(zhì)的溶解度曲線如圖2所示),分離得到NaOH的實驗操作步驟依次是 蒸發(fā)濃縮,冷卻結(jié)晶,過濾蒸發(fā)濃縮,冷卻結(jié)晶,過濾。
(4)為測定制得鹽酸的濃度,打開活塞K取10.00mL,加水稀釋成500.00mL,取稀釋液20.00mL,用0.108mol/L的標(biāo)準(zhǔn)NaOH溶液滴定,消耗了22.00mL,則制得鹽酸的濃度是 5.94mol/L5.94mol/L。滴定時若錐形瓶水洗后用稀釋液潤洗兩次(沒有干燥)后直接滴定,則測定結(jié)果會 偏大偏大 (選答“偏大”、“偏小”、“無影響”)。
電解
電解
【答案】2NaCl+2H2O 2NaOH+H2↑+Cl2↑;便于氯化氫氣體被水吸收,防止氣體擴(kuò)散到空氣中;蒼白色火焰,且產(chǎn)生白霧;正極;外管中為H2,內(nèi)管中為Cl2,所以B極產(chǎn)生氯氣,為陽極,陽極與電源的正極相連;蒸發(fā)濃縮,冷卻結(jié)晶,過濾;5.94mol/L;偏大
電解
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:33引用:1難度:0.7
相似題
-
1.(NH4)2S2O8電化學(xué)循環(huán)氧化法可用于廢水中苯酚的降解,示意圖如圖。
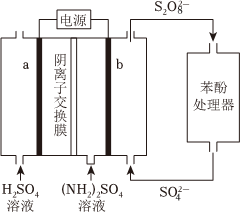
(1)(NH4)2S2O8的電解法制備。
已知:電解效率η的定義為η(B)=×100%。n(生成B所用的電子)n(通過電極的電子)
①電極b是極。
②生成S2的電極反應(yīng)式是O2-8。
③向陽極室和陰極室各加入100mL溶液。制備S2的同時,還在電極b表面收集到2.5×10-4mol氣體,氣體是O2-8。經(jīng)測定η(S2)為80%,不考慮其他副反應(yīng),則制備的(NH4)2S2O8的物質(zhì)的量濃度為O2-8mol/L。
(2)苯酚的降解
已知:?具有強(qiáng)氧化性,F(xiàn)e2+性度較高時會導(dǎo)致SO-4?猝滅。S2SO-4可將苯酚氧化為CO2,但反應(yīng)速率較慢。加入Fe2+可加快反應(yīng),過程為:O2-8
i.S2+Fe2+═O2-8+SO2-4?+Fe3+SO-4
ii.?將苯酚氧化SO-4
①?氧化苯酚的離子方程式是SO-4。
②將電解得到的含S2溶液稀釋后加入苯酚處理器,調(diào)節(jié)溶液總體積為1L,pH=1,測得在相同時間內(nèi),不同條件下苯酚的降解率如圖。O2-8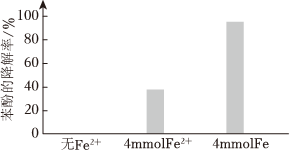
用等物質(zhì)的量的鐵粉代替FeSO4,可明顯提高苯酚的降解率,主要原因是。
(3)苯酚殘留量的測定
已知:電解中轉(zhuǎn)移1mol電子所消耗的電量為F庫侖。
取處理后的水樣100mL,酸化后加入KBr溶液,通電。電解產(chǎn)生的Br2全部與苯酚反應(yīng),當(dāng)苯酚完全反應(yīng)時,消耗的電量為a庫侖,則樣品中苯酚的含量為g/L。(苯酚的摩爾質(zhì)量:94g/mol)發(fā)布:2024/12/30 11:30:1組卷:161引用:2難度:0.4 -
2.鈰(Ce)是鑭系金屬元素。空氣污染物NO通常用含Ce4+的溶液吸收,生成HNO2、
,再利用電解法將上述吸收液中的HNO2轉(zhuǎn)化為無毒物質(zhì),同時生成Ce4+,其原理如圖所示。下列說法正確的是( )NO-3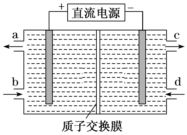
A.H+由右室進(jìn)入左室 B.Ce4+從電解槽的c口流出,且可循環(huán)使用 C.陰極的電極反應(yīng)式:2HNO2+6H++6e-═N2↑+4H2O D.若用甲烷燃料電池作為電源,當(dāng)消耗標(biāo)準(zhǔn)狀況下33.6L甲烷時,理論上可轉(zhuǎn)化2mol HNO2 發(fā)布:2025/1/6 7:30:5組卷:129引用:7難度:0.7 -
3.如圖所示,某同學(xué)設(shè)計一個甲醚(CH3OCH3)燃料電池并探究氯堿工業(yè)原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。
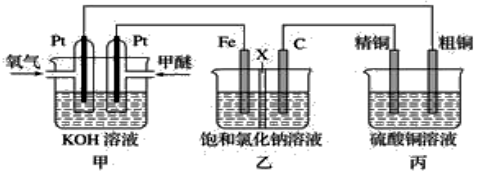
(1)通入氧氣的電極為極,寫出負(fù)極電極反應(yīng)式。
(2)鐵電極為極,石墨電極(C)的電極反應(yīng)式為。
(3)反應(yīng)一段時間后,乙裝置中生成NaOH主要在(填“鐵極”或“石墨極”)區(qū)。
(4)如果粗銅中含有鋅、銀等雜質(zhì),丙裝置中陽極上電極反應(yīng)式為,反應(yīng)一段時間,硫酸銅溶液濃度將(填“增大”、“減小”或“不變”)發(fā)布:2025/1/3 8:0:1組卷:6引用:1難度:0.6
相關(guān)試卷


