氮的化合物在工農業生產中有著重要的作用,氮的化合物也會對大氣及水體等產生污染,在利用這些物質的同時,治理和減少污染是重要的課題。
(1)NH3和N2H4是氮元素的兩種重要的氫化物。
①結合NH3分子的結構和性質,解釋NH3常用作制冷劑的原因 液氨氣化時吸收大量熱,使周圍環境溫度降低液氨氣化時吸收大量熱,使周圍環境溫度降低。
②N2H4能使鍋爐內壁的鐵銹(Fe2O3?xH2O)變成磁性氧化層,減緩鍋爐銹蝕,且不產生污染物。寫出N2H4與鐵銹反應的化學方程式為 N2H4+6 Fe2O3?xH2O=N2+4Fe3O4+(6x+2)H2ON2H4+6 Fe2O3?xH2O=N2+4Fe3O4+(6x+2)H2O。
(2)NO和NO2是氮元素的兩種常見的氧化物,它們之間可以相互轉化。NOx會導致光化學煙霧的形成。
①2NO(g)+O2(g)?2NO2(g)由以下反應復合而成。
反應Ⅰ:2NO(g)?N2O2(g) ΔH1
反應Ⅱ:N2O2(g)+O2(g)?2NO2(g) ΔH2
其反應進程與能量變化的關系示意圖如圖1所示。NO氧化為NO2的總反應速率由反應Ⅱ控制,原因是 由圖像可知:Ea2>Ea1,反應I的活化能比反應小,反應II活化能較大,反應的活化能越大,反應速率越慢,決定了總反應速率由圖像可知:Ea2>Ea1,反應I的活化能比反應小,反應II活化能較大,反應的活化能越大,反應速率越慢,決定了總反應速率。
在恒容的密閉容器中充入一定量的NO和O2氣體,保持其它條件不變,控制反應溫度分別為T1和T2(T1>T2),測得c(NO)隨t(時間)的變化曲線如圖2所示。由圖可知,轉化相同量的NO,在溫度T1下消耗的時間較長,其可能的原因是 反應I的△H1<0,溫度升高,反應I的化學平衡逆向移動,c(N2O2)減小,濃度降低對反應速率的影響大于溫度升高對反應速率II的影響反應I的△H1<0,溫度升高,反應I的化學平衡逆向移動,c(N2O2)減小,濃度降低對反應速率的影響大于溫度升高對反應速率II的影響。
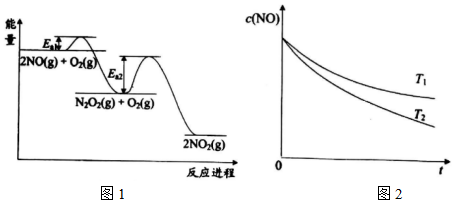
②光化學煙霧形成時,部分物質發生光化學反應的過程如圖3,虛線方框內的過程可描述為 線框中是NO2在紫外線照射下產生游離的O原子,O與O2結合形成O3,然后是CH2=CH-CH3與O3發生氧化還原反應反應產生CH3CHO、HCHO線框中是NO2在紫外線照射下產生游離的O原子,O與O2結合形成O3,然后是CH2=CH-CH3與O3發生氧化還原反應反應產生CH3CHO、HCHO。
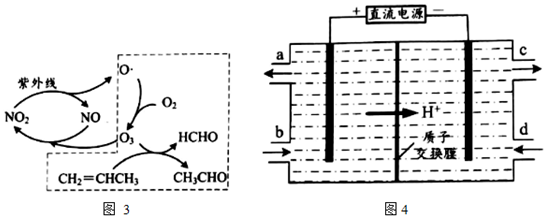
(3)含鈰溶液可以處理大氣中的氮氧化物,并可通過電解法再生。
鈰元素(Ce)常見的化合價有+3價、+4價。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-。可采用電解法將上述吸收液中的NO2-轉化為無毒物質,同時再生Ce4+,其原理如圖4所示。陰極的電極反應式為 2NO2-+8H++6e-=N2↑+4H2O2NO2-+8H++6e-=N2↑+4H2O。
【答案】液氨氣化時吸收大量熱,使周圍環境溫度降低;N2H4+6 Fe2O3?xH2O=N2+4Fe3O4+(6x+2)H2O;由圖像可知:Ea2>Ea1,反應I的活化能比反應小,反應II活化能較大,反應的活化能越大,反應速率越慢,決定了總反應速率;反應I的△H1<0,溫度升高,反應I的化學平衡逆向移動,c(N2O2)減小,濃度降低對反應速率的影響大于溫度升高對反應速率II的影響;線框中是NO2在紫外線照射下產生游離的O原子,O與O2結合形成O3,然后是CH2=CH-CH3與O3發生氧化還原反應反應產生CH3CHO、HCHO;2NO2-+8H++6e-=N2↑+4H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:44引用:3難度:0.6
相似題
-
1.硫和氮及其化合物在生產生活中應用廣泛,含氮氧化物和硫氧化物的尾氣需處理后才能排放。請回答下列問題:
(1)稀硫酸、稀硝酸與銅粉反應制膽礬晶體,過程中生成一種無色氣體,該氣體是(填化學式),制得的膽礬晶體中可能存在的雜質是(填名稱)。
(2)Na2SO3是實驗室重要的常見藥品,有一瓶放置了很久,小明同學想設計一個實驗驗證這瓶藥品是否變質。請你幫助他設計一個實驗。
(3)一種NH3催化還原NO的物質轉化如圖所示。若參與反應的NH3和O2物質的量之比為4:1,寫出轉化時總反應的化學方程式:。
(4)利用氨水可以將SO2和NO2吸收,原理如圖所示:
NO2被吸收的離子方程式是。
(5)在酸性NaClO溶液中,HClO氧化NO生成Cl-和。其他條件相同,NO轉化為NO-3的轉化率隨NaClO溶液初始pH(用稀鹽酸調節)的變化如圖所示。NaClO溶液的初始pH越小,NO轉化率越高。其原因是NO-3。發布:2024/12/30 3:30:1組卷:55引用:1難度:0.5 -
2.下列關于氮的氧化物的說法中正確的是( )
A.氮的氧化物都是酸性氧化物,都是大氣污染物 B.氮的氧化物都既有氧化性,又有還原性 C.NO2與H2O反應生成 HNO3,所以NO2是酸性氧化物 D.可用排空氣法收集NO2 發布:2024/12/30 6:0:2組卷:28引用:2難度:0.5 -
3.下列關于自然界中氮循環(如圖)的說法不正確的是( )

A.人工固氮可以得到硝酸鹽 B.雷電作用可將氮氣直接轉化為銨鹽 C.細菌對氮元素的循環有重要作用 D.亞硝酸鹽轉化為硝酸鹽的過程中,氮元素被氧化 發布:2024/12/30 4:0:1組卷:141引用:2難度:0.9


