2021-2022學年江蘇省揚州中學高三(上)月考化學試卷(10月份)
發布:2025/1/7 13:30:2
一、單項選擇題:本題共14個小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.《厲害了,我的國》“中國名片”中航天、軍事天文等領域的發展受到世界矚目。它們與化學有著密切聯系。下列說法正確的是( )
A.“中國天眼”的“眼眶”是鋼鐵結成的圈梁,屬于新型無機非金屬材料 B.“復興號”車廂連接處關鍵部位使用的增強聚四氟乙烯板屬于無機金屬材料 C.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結構陶瓷是新型無機非金屬材料 D.“天宮二號”空間實驗室的太陽能電池板的主要材料是二氧化硅 組卷:94引用:4難度:0.9 -
2.甲醛是家庭裝修常見的污染物。一種催化氧化甲醛的反應為:HCHO+O2
H2O+CO2。下列正確的是( )PtA.HCHO分子中鍵σ和π鍵的數目之比為2:1 B.16O原子中的中子數為16 C.H2O是由極性鍵構成的非極性分子 D.CO2的空間構型為直線形 組卷:104引用:5難度:0.8 -
3.實驗室制備硝基苯時,經過配制混酸、硝化反應(50~60℃)、洗滌分液、干燥蒸餾等步驟,下列圖示裝置和原理能達到實驗目的的是( )
A. 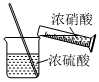
配制混酸B. 
硝化反應C. 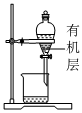
分離硝基苯D. 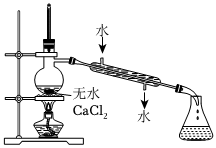
蒸餾硝基苯組卷:156引用:15難度:0.7 -
4.閱讀下列資料,完成4~5題:
工業上利用炭和水蒸氣反應:C(s)+H2O(g)?CO(g)+H2(g)ΔH1,CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2生成的H2為原料合成氨。在飽和的食鹽水中先通NH3,后通CO2,由于HCO3-能形成多聚體,所以容易析出NaHCO3,過濾后熱分解得純堿。
有關氨的說法不正確的是( )A.氨氣溶于水能導電,所以氨氣是電解質 B.氨氣易液化,液氨可用作制冷劑 C.NH3極易溶于水,可做噴泉實驗 D.氨氣中氮元素的雜化類型sp3雜化 組卷:1引用:0難度:0.70 -
5.閱讀下列資料,完成4~5題:
工業上利用炭和水蒸氣反應:C(s)+H2O(g)?CO(g)+H2(g)ΔH1,CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2生成的H2為原料合成氨。在飽和的食鹽水中先通NH3,后通CO2,由于HCO3-能形成多聚體,所以容易析出NaHCO3,過濾后熱分解得純堿。
我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程。該歷程示意圖如圖,下列說法不正確的是( )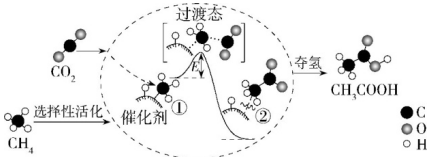
A.生成CH3COOH總反應的原子利用率為100% B.該催化劑可有效提高反應物的平衡轉化率 C.①→②放出能量并形成了C-C鍵 D.CH4→CH3COOH過程中,有C-H鍵發生斷裂 組卷:6引用:0難度:0.70
二、非選擇題:共4題,(共58分)。
-
17.金常以微細粒浸染于黃鐵礦、含砷黃鐵礦中,此類礦石的預氧化處理方法主要有:焙燒氧化、生物氧化和濕法氧化。
(1)含砷黃鐵礦(主要成分為FeAsS)高溫焙燒氧化后,再用氰化鈉(NaCN)溶液浸出。已知:氫氰酸(HCN)易揮發,有劇毒。
①焙燒氧化的產物有As4O6、Fe3O4,該反應的化學方程式為。
②焙燒氧化的缺點為。
③采用電解法除去反應剩余液中有毒物質,CN-在陽極區被去除。在pH=10時,CN-去除效果最佳且能耗最低,原因是。
(2)利用細菌進行生物氧化提取金,pH對金的浸出率影響如圖1所示。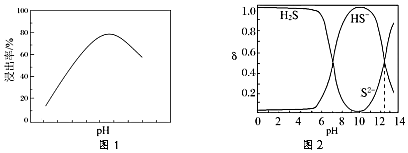
pH影響金浸出率的原因是。
(3)濕法氧化是在溶液中化學物質的作用下提取金。已知Au的硫酸鹽難溶于水,Au+與Sx2-、S2O32-等形成配合物。
①工業上利用硫代硫酸鹽可浸出金生成Au(S2O3)23-,但在富氧條件下浸出率明顯降低,原因是。
②常溫下,已知H2S-HS--S2-粒子體系隨pH變化各組分分布如圖2所示,δ(H2S)=。多硫化物浸金的一種原理是:混合體系在通空氣條件下氧化時,體系中S2-先被氧化為S,再轉化為S42-。研究發現S42-可將Au氧化為AuS-,pH=11時 S42-將Au氧化的離子方程式為c(H2S)c(H2S)+c(HS-)+c(S2-)。組卷:39引用:3難度:0.5 -
18.氮的化合物在工農業生產中有著重要的作用,氮的化合物也會對大氣及水體等產生污染,在利用這些物質的同時,治理和減少污染是重要的課題。
(1)NH3和N2H4是氮元素的兩種重要的氫化物。
①結合NH3分子的結構和性質,解釋NH3常用作制冷劑的原因。
②N2H4能使鍋爐內壁的鐵銹(Fe2O3?xH2O)變成磁性氧化層,減緩鍋爐銹蝕,且不產生污染物。寫出N2H4與鐵銹反應的化學方程式為。
(2)NO和NO2是氮元素的兩種常見的氧化物,它們之間可以相互轉化。NOx會導致光化學煙霧的形成。
①2NO(g)+O2(g)?2NO2(g)由以下反應復合而成。
反應Ⅰ:2NO(g)?N2O2(g) ΔH1
反應Ⅱ:N2O2(g)+O2(g)?2NO2(g) ΔH2
其反應進程與能量變化的關系示意圖如圖1所示。NO氧化為NO2的總反應速率由反應Ⅱ控制,原因是。
在恒容的密閉容器中充入一定量的NO和O2氣體,保持其它條件不變,控制反應溫度分別為T1和T2(T1>T2),測得c(NO)隨t(時間)的變化曲線如圖2所示。由圖可知,轉化相同量的NO,在溫度T1下消耗的時間較長,其可能的原因是。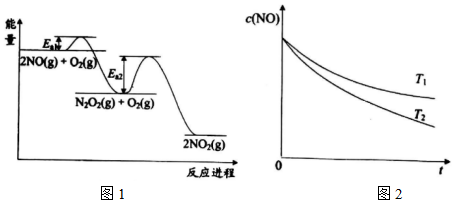
②光化學煙霧形成時,部分物質發生光化學反應的過程如圖3,虛線方框內的過程可描述為。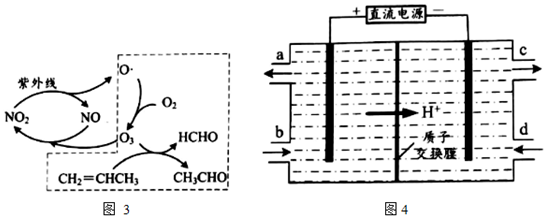
(3)含鈰溶液可以處理大氣中的氮氧化物,并可通過電解法再生。
鈰元素(Ce)常見的化合價有+3價、+4價。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-。可采用電解法將上述吸收液中的NO2-轉化為無毒物質,同時再生Ce4+,其原理如圖4所示。陰極的電極反應式為。組卷:44引用:3難度:0.6


