某種工業廢水中含有一定量的Cr2O72-和CrO42-,它們易被人體吸收積累而導致肝癌。
I、污水處理廠常用還原沉淀法處理含鉻廢水,其流程如圖:
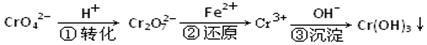
(1)已知第①步存在平衡:2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O
①Cr2O72-中Cr的化合價是 +6+6。
②常溫下,若平衡體系的pH=12,則溶液顯 黃黃色。
(2)第②步發生反應的離子方程式為 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
(3)往FeCl3+3KSCN?3KCl+Fe(SCN)3的平衡體系中加少量的KCl固體,平衡向哪個方向移動 不移動不移動(向逆反應方向、向正反應方向、不移動)。
II、取樣該工業廢水,檢測其中鉻的含量。
步驟Ⅰ:取25.00mL廢水于錐形瓶中,加入適量稀硫酸酸化。
步驟Ⅱ:加入過量的碘化鉀溶液,充分反應后滴入幾滴淀粉作指示劑。
步驟Ⅲ:用0.1000mol?L-1的Na2S2O3溶液測定上面產生的碘單質。
(I2+2Na2S2O3═2NaI+Na2S4O6)當溶液由藍色變無色時為滴定終點,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL廢水經酸化后,含有Cr2O72-的物質的量為 3×10-43×10-4mol。
【答案】+6;黃;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;不移動;3×10-4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:9引用:1難度:0.4
相似題
-
1.將一定量鋅與100mL 18mol/L濃硫酸充分反應后,若鋅完全溶解同時產生氣體0.8mol,將反應后的溶液稀釋得400mL,測得溶液o(H+)=2mol/L,則下列敘述中錯誤的是( )
A.氣體中SO2和H2物質的量比為6:1 B.反應中共消耗鋅52.0g C.所得氣體應該為SO2和H2混合物 D.反應共轉移電子1.6mol 發布:2024/12/30 4:30:1組卷:80引用:5難度:0.4 -
2.向100mL 18mol/L的硫酸溶液中加入足量的銅片并加熱,充分反應后,被還原的硫酸物質的量( )
A.小于0.9 mol B.等于0.9 mol C.在0.9 mol到1.8 mol之間 D.大于1.8 mol 發布:2024/12/30 14:0:1組卷:33引用:2難度:0.9 -
3.已知硫代硫酸鈉可作為脫氯劑,25.0mL0.100mol?L-1的Na2S2O3溶液恰好把224mL(標準狀況下)Cl2轉化為Cl-,則S2
將轉化為( )O2-3A.S2- B.S C. SO2-3D. SO2-4發布:2024/12/30 4:30:1組卷:134引用:5難度:0.5


