某化學小組欲測定KClO3溶液與NaHSO3溶液反應的化學反應速率,所用試劑為10mL0.1mol?L-1KClO3溶液和10mL0.3mol?L-1NaHSO3溶液,所得溶液中c(Cl-)隨時間變化的曲線如圖所示。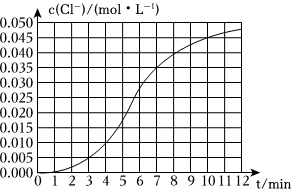
(1)該反應的離子方程式是 ClO-3+3HSO-3=Cl-+3SO2-4+3H+ClO-3+3HSO-3=Cl-+3SO2-4+3H+。
(2)根據實驗數據可知,該反應在0~4min內的平均反應速率v(Cl-)=0.0025 mol?L-1?min-10.0025 mol?L-1?min-1。
(3)某同學仔細分析實驗數據后發現,在反應過程中,該反應的反應速率先增大后減小。該同學設計如下實驗方案,進一步探究反應速率先增大的原因。
C
l
O
-
3
HSO
-
3
SO
2
-
4
C
l
O
-
3
HSO
-
3
SO
2
-
4
| 方案 | 假設 | 實驗操作 |
| Ⅰ |
該反應放熱,使溶液溫度升高,反應速率加快 該反應放熱,使溶液溫度升高,反應速率加快 ,反應速率加快 |
向燒杯中加入10mL0.1mol?L-1KClO3溶液和10mL0.3mol?L-1NaHSO3溶液,插入溫度計 |
| Ⅱ | 生成的Cl-對反應有催化作用,加快了反應速率 | 取10mL0.1mol?L-1KClO3溶液于燒杯中,先加入少量 NaCl(或KCl) NaCl(或KCl) 固體,再加入10mL0.3mol?L-1NaHSO3溶液 |
| Ⅲ | 反應中溶液酸性增強,加快了反應速率 | 分別向a、b兩個燒杯中加入10mL0.1mol?L-1KClO3溶液;向燒杯a中加入1mL蒸餾水,向燒杯b中加入1mL0.2mol?L-1鹽酸;再分別向兩個燒杯中加入10mL0.3mol?L-1NaHSO3溶液 |
該反應放熱,使溶液溫度升高,反應速率加快
該反應放熱,使溶液溫度升高,反應速率加快
。②方案Ⅱ中加入的固體為
NaCl(或KCl)
NaCl(或KCl)
(填化學式)。③除Ⅰ、Ⅱ、Ⅲ中的假設外,還可以提出的假設是
生成的加快了化學反應速率
SO
2
-
4
生成的加快了化學反應速率
。SO
2
-
4
④某同學從控制變量的角度思考,認為方案Ⅲ中實驗操作設計不嚴謹,請進行改進:
將1mL水改lmL0.2mol/LNaCl溶液
將1mL水改lmL0.2mol/LNaCl溶液
。(4)試分析反應后期化學反應速率減小的原因:
隨著化學反應的進行,體系中的各物質濃度都會逐漸降低,反應速率也會逐漸減慢
隨著化學反應的進行,體系中的各物質濃度都會逐漸降低,反應速率也會逐漸減慢
。【答案】+3=Cl-+3+3H+;0.0025 mol?L-1?min-1;該反應放熱,使溶液溫度升高,反應速率加快;NaCl(或KCl);該反應放熱,使溶液溫度升高,反應速率加快;NaCl(或KCl);生成的加快了化學反應速率;將1mL水改lmL0.2mol/LNaCl溶液;隨著化學反應的進行,體系中的各物質濃度都會逐漸降低,反應速率也會逐漸減慢
C
l
O
-
3
HSO
-
3
SO
2
-
4
SO
2
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:36引用:6難度:0.6
相似題
-
1.下列條件的變化,是因為吸收能量而增加單位體積內的反應物活化分子百分數致使反應速率加快的是( )
A.增大濃度 B.增大壓強 C.升高溫度 D.使用催化劑 發布:2025/1/6 6:0:5組卷:3引用:1難度:0.8 -
2.在恒溫恒容的容器里進行下列反應:N2+3H2?2NH3,其他條件不變,向容器中充入氬氣,則此反應速率會( )
A.變大 B.變小 C.不變 D.無法判斷 發布:2025/1/6 6:0:5組卷:51引用:3難度:0.9 -
3.下列措施能明顯增大原反應的化學反應速率的是( )
A.Na與水反應時增大水的用量 B.恒溫恒容條件下,在工業合成氨反應中,增加氮氣的量 C.在H2SO4與NaOH兩溶液反應時,增大壓強 D.將稀H2SO4改為98%的濃H2SO4與Zn反應制取H2 發布:2025/1/6 6:0:5組卷:9引用:2難度:0.7


