2022-2023學(xué)年福建省廈門(mén)一中高二(上)第一次月考化學(xué)試卷
發(fā)布:2024/9/20 17:0:8
?一、單選題
-
1.為了實(shí)現(xiàn)“碳達(dá)峰”和“碳中和”,太陽(yáng)能的利用逐漸得到重視。下列說(shuō)法錯(cuò)誤的是( )
A.煤、石油和天然氣都屬于碳素燃料 B.發(fā)展太陽(yáng)能經(jīng)濟(jì)有助于減緩溫室效應(yīng) C.太陽(yáng)能電池可將太陽(yáng)能直接轉(zhuǎn)化為電能 D.太陽(yáng)能的直接利用只有“光-電轉(zhuǎn)換”和“光-生物質(zhì)能轉(zhuǎn)換”兩種形式 組卷:32引用:4難度:0.6 -
2.某同學(xué)設(shè)計(jì)如圖所示實(shí)驗(yàn),探究反應(yīng)中的能量變化。下列判斷正確的是( )
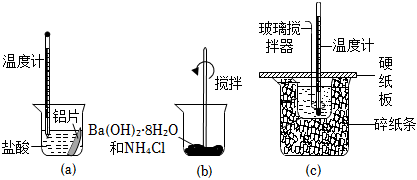
A.實(shí)驗(yàn)(a)、(b)、(c)所涉及的反應(yīng)都是放熱反應(yīng) B.將實(shí)驗(yàn)(a)中的鋁片更換為等質(zhì)量的鋁粉后釋放出的熱量有所增加 C.實(shí)驗(yàn)(c)中將玻璃攪拌器改為鐵質(zhì)攪拌棒對(duì)實(shí)驗(yàn)結(jié)果沒(méi)有影響 D.實(shí)驗(yàn)(c)中若用NaOH固體測(cè)定,則測(cè)定數(shù)值偏高 組卷:68引用:10難度:0.7 -
3.下列事實(shí)不能用勒夏特列原理解釋的是( )
A.Fe(SCN)3溶液中加入固體KSCN后顏色變深 B.使用新型催化劑可使氮?dú)馀c氫氣在常溫常壓下合成氨氣 C.用排飽和食鹽水的方法收集氯氣 D.石灰石與稀鹽酸在密閉瓶中反應(yīng)結(jié)束后,打開(kāi)瓶塞,溶液中有氣泡產(chǎn)生 組卷:7引用:2難度:0.8 -
4.血紅蛋白分子(Hb)在人體中存在如下過(guò)程:①Hb+O2(g)?Hb(O2) K1;②Hb+CO(g)?Hb(CO) K2。下列說(shuō)法錯(cuò)誤的是( )
A.高原地區(qū)含氧量低,因此該地區(qū)人體內(nèi)的Hb數(shù)量普遍較高 B.人體吸入CO會(huì)造成缺氧,說(shuō)明K2>K1 C.CO中毒時(shí),需立即切斷CO源,使K2變小 D.CO中毒時(shí),可將病人移入高壓氧艙,使反應(yīng)①Q(mào)<K1 組卷:46引用:4難度:0.8 -
5.將一定量純凈的氨基甲酸銨置于密閉真空恒容容器中(固體試樣體積忽略不計(jì)),在恒定溫度下使其達(dá)到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).判斷該分解反應(yīng)已經(jīng)達(dá)到化學(xué)平衡的是( )
A.2v(NH3)=v(CO2) B.密閉容器中c(NH3):c(CO2)=2:1 C.密閉容器中混合氣體的密度不變 D.密閉容器中氨氣的體積分?jǐn)?shù)不變 組卷:593引用:27難度:0.9 -
6.汽車(chē)尾氣凈化中的某反應(yīng):NO(g)+CO(g)?
N2(g)+CO2(g)△H=-373.4kJ?mol-1在恒容的密閉容器中,反應(yīng)達(dá)到平衡后,改變某一條件,下列示意圖正確的是( )12A. 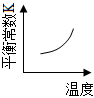
B. 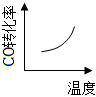
C. 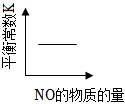
D. 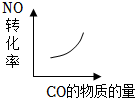 組卷:9引用:5難度:0.5
組卷:9引用:5難度:0.5
-
18.二甲醚(CH3OCH3)是重要的化工原料,也是一種清潔的能源,可用CO和H2制得,由合成氣制備二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)ΔH1═-90.7kJ?mol-1K1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH2═-23.5kJ?mol-1K2
③CO(g)+H2O(g)?CO2(g)+H2(g)ΔH3═-41.2kJ?mol-1K3
(1)反應(yīng)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的ΔH═kJ?mol-1;該反應(yīng)的平衡常數(shù)K═(用K1、K2、K3表示)。
(2)下列措施中,能提高①中CH3OH產(chǎn)率的有。
A.使用過(guò)量的CO
B.升高溫度
C.增大壓強(qiáng)
D.使用催化劑
(3)將合成氣以=2通入1L的反應(yīng)器中,一定條件下發(fā)生反應(yīng):4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)ΔH,其中CO的平衡轉(zhuǎn)化率隨溫度、壓強(qiáng)的變化關(guān)系如圖所示,下列說(shuō)法正確的是n(H2)n(CO)(填字母)。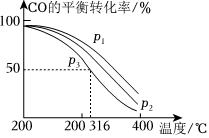
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃時(shí),起始時(shí)=3,則平衡時(shí),α(CO)小于50%n(H2)n(CO)
(4)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2制備二甲醚(DME)。觀察圖,當(dāng)約為n(Mn)n(Cu)時(shí)最有利于二甲醚的合成。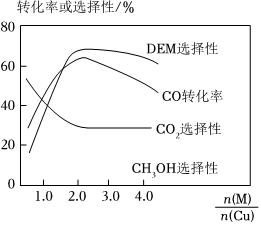
(5)如圖為綠色電源“二甲醚燃料電池”的工作原理示意圖,a極生成的氣體是,b電極的電極反應(yīng)式為。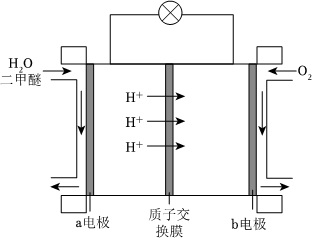
(6)甲醇液相脫水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。與合成氣制備二甲醚比較,該工藝的優(yōu)點(diǎn)是反應(yīng)溫度低,轉(zhuǎn)化率高,其缺點(diǎn)是。組卷:7引用:2難度:0.6 -
19.習(xí)近平總書(shū)記在世界領(lǐng)導(dǎo)人氣候峰會(huì)上指出,中國(guó)將在2030年前實(shí)現(xiàn)“碳達(dá)峰”、2060年前實(shí)現(xiàn)“碳中和”。這是中國(guó)基于推動(dòng)構(gòu)建人類(lèi)命運(yùn)共同體的責(zé)任擔(dān)當(dāng)和實(shí)現(xiàn)可持續(xù)發(fā)展的內(nèi)在要求作出的重大戰(zhàn)略決策。因此CO2的捕集、創(chuàng)新利用與封存成為科學(xué)家研究的重要課題。
(1)最近有科學(xué)家提出“綠色自由”構(gòu)想:先把空氣吹入飽和碳酸鉀溶液,然后再把CO2從溶液中提取出來(lái),并使之變?yōu)榭稍偕剂霞状肌!熬G色自由”構(gòu)想技術(shù)流程如圖: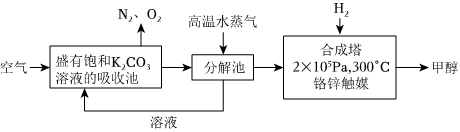
上述工藝中采用氣液逆流接觸吸收(空氣從吸收池底部進(jìn)入,溶液從頂部噴淋),其目的是。寫(xiě)出吸收池中反應(yīng)的化學(xué)方程式。
(2)CO2和H2合成甲烷也是CO2資源化利用的重要方法。一定條件下Pd-Mg/SiO2催化劑可使CO2“甲烷化”從而變廢為寶,其反應(yīng)機(jī)理如圖1所示,該反應(yīng)的化學(xué)方程式為,反應(yīng)過(guò)程中碳元素的化合價(jià)為-2價(jià)的中間體是。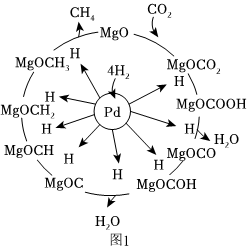
(3)將CO2和CH4作為原料制造合成氣的方法如下:200℃時(shí),以鎳合金為催化劑,向4L容器中通入4molCO2、4molCH4發(fā)生如下反應(yīng):CO2(g)+CH4(g)?2CO(g)+2H2(g)ΔH═+247kJ/mol。平衡體系中各組分體積分?jǐn)?shù)如下表:
①此溫度下該反應(yīng)的平衡常數(shù)K=物質(zhì) CH4 CO2 CO H2 體積分?jǐn)?shù) 0.3 0.3 0.2 0.2 。
②為了探究反應(yīng)CO2(g)+CH4(g)?2CO(g)+2H2(g)的反應(yīng)速率與濃度的關(guān)系,起始時(shí)向恒容密閉容器中通入CO2與CH4,使其物質(zhì)的量濃度均為1.0mol/L,根據(jù)相關(guān)數(shù)據(jù),粗略地繪制出兩條速率-濃度關(guān)系曲線(如圖):v正~c(CH4)和v逆~c(CO)。則與v正~c(CH4)相對(duì)應(yīng)曲線是圖中(填“甲”或“乙”);該反應(yīng)達(dá)到平衡后,某一時(shí)刻降低溫度反應(yīng)重新達(dá)到平衡,則此時(shí)v正、v逆相應(yīng)的平衡點(diǎn)分別為(填字母)。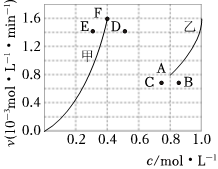 組卷:5引用:2難度:0.5
組卷:5引用:2難度:0.5


