第四周期的元素形成的化合物在生產(chǎn)生活中有著重要的用途。
(1)鎳鉻鋼抗腐蝕性能強,基態(tài)鉻原子的核外電子排布式為 1s22s22p63s23p63d54s11s22s22p63s23p63d54s1,按照電子排布式,鎳元素在周期表中位于 dd區(qū)。
(2)硒常用作光敏材料,基態(tài)硒原子的價電子排布式為 4s24p44s24p4。
(3)“玉兔二號”月球車是通過砷化鎵(GaAs)太陽能電池提供能量進行工作的。基態(tài)砷原子的電子占據(jù)最高能級的電子云輪廓圖為 啞鈴啞鈴形。基態(tài)鎵原子的核外有 11個未成對電子。
(4)基態(tài)Fe原子價層電子軌道表示式為 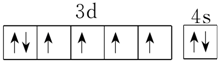
 。
。
(5)在BF3分子中,F(xiàn)-B-F的鍵角是 120°120°,硼原子的雜化軌道類型為 sp2sp2,BF3和過量NaF作用可生成NaBF4,BF-4的空間構(gòu)型為 正四面體正四面體。
(6)H2O2為 極性極性分子(填“極性”或“非極性”)。
BF
-
4
【答案】1s22s22p63s23p63d54s1;d;4s24p4;啞鈴;1; ;120°;sp2;正四面體;極性
;120°;sp2;正四面體;極性
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:124引用:1難度:0.6
相似題
-
1.根據(jù)VSEPR模型和雜化軌道理論對磷酸根(
)的空間結(jié)構(gòu)的預測和解釋中,完全正確的是( )PO3-4A.磷酸根離子的空間結(jié)構(gòu)為三角錐形 B.中心原子P的價層電子對數(shù)為4 C.中心原子P的雜化軌道類型為sp3 D.中心原子P的孤電子對數(shù)為1 發(fā)布:2025/1/5 8:0:1組卷:6引用:1難度:0.8 -
2.根據(jù)雜化軌道理論和價層電子對互斥模型判斷,下列說法不正確的是( )
選項 粒子 中心原子雜化方式 VSEPR模型 空間結(jié)構(gòu) A CO2 sp 直線形 直線形 B NH3 sp3 四面體形 三角錐形 C CO2-3sp2 四面體形 平面三角形 D H3O+ sp3 四面體形 三角錐形 A.A B.B C.C D.D 發(fā)布:2025/1/5 8:0:1組卷:78引用:3難度:0.6 -
3.通常把原子總數(shù)和價電子總數(shù)相同的分子或離子稱為等電子體。人們發(fā)現(xiàn)等電子體的空間結(jié)構(gòu)相同,則下列有關(guān)說法中正確的是( )
A.CH4和NH4+是等電子體,鍵角均為60° B.H3O+和PCl3是等電子體,均為平面三角形結(jié)構(gòu) C.NO3-和CO32-是等電子體,均為三角錐形結(jié)構(gòu) D.B3N3H6和苯是等電子體,B3N3H6分子中存在“肩并肩”式重疊的軌道 發(fā)布:2024/12/30 18:0:1組卷:12引用:2難度:0.8
相關(guān)試卷


