過氧化氫在生產(chǎn)、生活中有廣泛應(yīng)用。實驗小組對過氧化氫進行系列研究。
Ⅰ、實驗小組在實驗室進行過氧化氫制取氧氣的探究。
【實驗1】探究催化劑(MnO2)的用量對過氧化氫分解速率的影響。每次實驗均用30mL10%的H2O2溶液,采用不同質(zhì)量MnO2粉末做催化劑,測定收集到500mL氧氣所用的時間,結(jié)果如表:
| 實驗序號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| MnO2粉末用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用時間/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 |
H2O2H2O+O2或過氧化氫水+氧氣
M
n
O
2
二氧化錳
H2O2H2O+O2或過氧化氫水+氧氣
。M
n
O
2
二氧化錳
(2)由實驗1的實驗結(jié)果可得出的結(jié)論是:一定范圍內(nèi),催化劑(MnO2)的用量越多,過氧化氫分解速率
越大
越大
(填“越大”或“越小”或“不變”,下同)。當(dāng)催化劑(MnO2)的用量超過一定范圍,過氧化氫分解速率 不變
不變
。【實驗2】探究次氯酸鈉能否作為過氧化氫分解反應(yīng)的催化劑
步驟1:在試管中加入2mL 5%過氧化氫溶液,把帶火星木條伸入試管,觀察現(xiàn)象。
步驟2:向步驟1中試管加入1mL漂白液(有效成分是次氯酸鈉【NaClO】),把帶火星的木條伸入試管,有大量氣泡冒出,帶火星的木條復(fù)燃。

(3)步驟1中,觀察到有氣泡產(chǎn)生,帶火星的小木條未復(fù)燃。實驗結(jié)論是
常溫下過氧化氫溶液分解很慢,放出的氧氣少,不足以使帶火星木條復(fù)燃
常溫下過氧化氫溶液分解很慢,放出的氧氣少,不足以使帶火星木條復(fù)燃
。(4)通過實驗2,能否判斷次氯酸鈉是該反應(yīng)的催化劑?
請回答:
否
否
(填“是”或“否”)。請寫出理由 因為無法證明次氯酸鈉在反應(yīng)前后的化學(xué)性質(zhì)和質(zhì)量是否改變
因為無法證明次氯酸鈉在反應(yīng)前后的化學(xué)性質(zhì)和質(zhì)量是否改變
。Ⅱ、過氧化氫具有漂白性
【查閱資料】1.過氧化氫【H2O2】溶液可漂白一些有色物質(zhì)。
2.10%表示H2O2溶液的濃度,該溶液中過氧化氫和水的質(zhì)量比為10:90。
【進行實驗】將紅色布條分別浸泡在4種溶液中,現(xiàn)象如表。
| 實驗① | 實驗② | 實驗③ | 實驗④ |

|

|

|

|
| 20分鐘后布條無明顯變化 | 20分鐘后布條顏色稍變淺 | 20分鐘后布條顏色明顯變淺 | 1分鐘后布條紅色褪去 |
(5)實驗①、②的目的是探究
反應(yīng)溫度
反應(yīng)溫度
對H2O2溶液的漂白性是否有影響。(6)欲得出“其他條件相同時,氫氧化鈉【NaOH】溶液對H2O2溶液的漂白性有影響”的結(jié)論,需要對比
②和③
②和③
(填實驗編號)。(7)通過對比實驗③、④,得出的結(jié)論是
相同條件下,過氧化氫濃度越高,H2O2溶液的漂白性越好
相同條件下,過氧化氫濃度越高,H2O2溶液的漂白性越好
。(8)欲進一步探究NaOH溶液的用量對H2O2溶液的漂白性的影響,可補充的實驗是:將紅色布條浸泡到
50
50
℃25mL10% H2O2溶液+5滴NaOH溶液中,觀察實驗現(xiàn)象。【答案】H2O2H2O+O2或過氧化氫水+氧氣;越大;不變;常溫下過氧化氫溶液分解很慢,放出的氧氣少,不足以使帶火星木條復(fù)燃;否;因為無法證明次氯酸鈉在反應(yīng)前后的化學(xué)性質(zhì)和質(zhì)量是否改變;反應(yīng)溫度;②和③;相同條件下,過氧化氫濃度越高,H2O2溶液的漂白性越好;50
M
n
O
2
二氧化錳
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:17引用:2難度:0.6
相似題
-
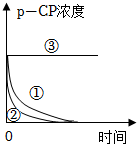 1.Fenton法常用于處理含難降解有機物的工業(yè)廢水。其原理是利用Fe2+和H2O2的反應(yīng)產(chǎn)生能降解污染物的活性成分。現(xiàn)運用該方法降解有機污染物p-CP,探究有關(guān)因素對降解反應(yīng)速率的影響。實驗探究:控制p-CP的初始濃度相同,實驗溫度恒定在25℃或40℃(其余實驗條件見下表)。
1.Fenton法常用于處理含難降解有機物的工業(yè)廢水。其原理是利用Fe2+和H2O2的反應(yīng)產(chǎn)生能降解污染物的活性成分。現(xiàn)運用該方法降解有機污染物p-CP,探究有關(guān)因素對降解反應(yīng)速率的影響。實驗探究:控制p-CP的初始濃度相同,實驗溫度恒定在25℃或40℃(其余實驗條件見下表)。
(1)請結(jié)合上述介紹將表中空格補充完整。
(2)實驗測得p-CP的濃度隨時間變化的關(guān)系如圖所示,根據(jù)實驗①、②圖像可得出結(jié)論:實驗編號 實驗?zāi)康?/td> 溫度/℃
pH濃度/(mg?L﹣1) H2O2 Fe2+ ① 為②③提供參照 25 3 204 16.8 ② 探究溫度對降解反應(yīng)速率的影響
3 204 16.8 ③ 探究溶液pH對降解反應(yīng)速率的影響 25 10 204 16.8 。
(3)為測定不同時間內(nèi)有機物降解的濃度,需在不同時間從反應(yīng)器中取樣,并使所取樣品中的降解反應(yīng)立即停止下來。根據(jù)本題信息,將樣品從反應(yīng)器中取出后應(yīng)立即將其放入某藥品中,反應(yīng)會迅速停止,該藥品可能是。
A鹽酸溶液 B氫氧化鈉溶液 C稀硫酸溶液 D碳酸鈉溶液發(fā)布:2024/11/25 8:0:2組卷:4引用:0難度:0.3 -
2.據(jù)圖1裝置圖回答問題
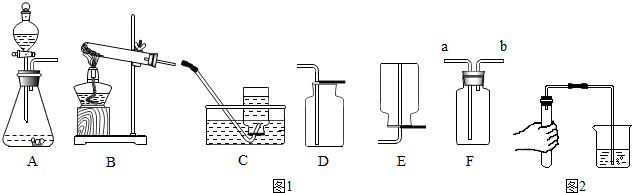
(1)甲同學(xué)用氯酸鉀和二氧化錳共熱制備和收集氧氣,他應(yīng)選用的氣體發(fā)生裝置是(填序號).他用裝置C來收集的原因是,當(dāng)看到導(dǎo)管口的時他才開始收集氧氣.
(2)該同學(xué)用如圖2所示的方法進行氣密性檢查,如果裝置不漏氣,可以看到,將手松開一段時間后(導(dǎo)管仍插入水中),可以看到導(dǎo)管中會形成一段水柱.
(3)因為氧氣的密度比空氣的稍大,所以還可以選用(填序號)來收集氧氣,其驗滿的方法是.
(4)老師提醒可以用F(萬能瓶)來收集氣體,則甲同學(xué)應(yīng)將發(fā)生裝置的導(dǎo)管與F的導(dǎo)管(選填a或b)相連接.
(5)乙同學(xué)稱取一定質(zhì)量的KMnO4固體放入大試管中,將溫度控制在250℃加熱制取O2.實驗結(jié)束時,這位同學(xué)發(fā)現(xiàn)用排水法收集到的O2大于理論產(chǎn)量.針對這一現(xiàn)象,同學(xué)們進行了如下探究:
【提出猜想】猜想Ⅰ:反應(yīng)生成的二氧化錳(MnO2)分解放出O2;
猜想Ⅱ:反應(yīng)生成的錳酸鉀(K2MnO4)分解放出O2;
【實驗驗證】同學(xué)們分成兩組,分別進行下列實驗:
第一組同學(xué)取一定質(zhì)量的MnO2,在250℃條件下加熱一段時間,冷卻后測得MnO2的質(zhì)量不變,則猜想(選填Ⅰ或Ⅱ)錯誤;
第二組同學(xué)取K2MnO4在250℃條件下加熱,沒有用測定質(zhì)量的方法得出了猜想Ⅱ正確的結(jié)論.該組同學(xué)選擇的實驗方法是.
【拓展延伸】實驗發(fā)現(xiàn),KClO3固體加熱制取O2的反應(yīng)速率很慢,但如果將KMnO4固體與KClO3固體混合加熱,則KClO3的分解速率大大加快,請說明KMnO4在KClO3的分解反應(yīng)中是否作催化劑,為什么?.
(6)丙同學(xué)選擇用雙氧水和二氧化錳混合來制氧氣,則他應(yīng)選用的氣體發(fā)生裝置是(填序號).以下是他探究影響該反應(yīng)速率因素的相關(guān)實驗數(shù)據(jù).
通過以上實驗數(shù)據(jù)的分析,可知,過氧化氫分解制氧氣的化學(xué)反應(yīng)速率與實驗
序號H2O2溶液濃度% H2O2溶液體積/mL 溫度℃ MnO2用量/g 收集到的
氧氣體積/mL反應(yīng)所需的
時間/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有關(guān);發(fā)生裝置中的(填儀器名稱)也可以幫助控制反應(yīng)的速率.發(fā)布:2024/12/18 8:0:1組卷:13引用:2難度:0.5 -
3.下列探究影響化學(xué)反應(yīng)速率因素的實驗中,實驗方案正確的是( )
選項 影響因素 實驗方案 A 接觸面積 將1g塊狀石灰石和20mL10%的稀鹽酸、1g粉末狀石灰石與20mL10%的稀硫酸混合,比較產(chǎn)生氣泡的快慢 B 催化劑的種類 將0.5g二氧化錳、1g氧化鐵分別與10mL6%的過氧化氫溶液混合,比較產(chǎn)生氣泡的快慢 C 反應(yīng)物的種類 分別將木炭在空氣中、氧氣中燃燒,比較反應(yīng)的劇烈程度 D 反應(yīng)物的性質(zhì) 分別用酒精燈加熱表面積相同的鎂片和鐵片,比較在空氣中能否被點燃 A.A B.B C.C D.D 發(fā)布:2024/12/25 13:0:1組卷:117引用:4難度:0.7


