純堿是玻璃、制皂、造紙、紡織和漂染等工業的基本原料。
Ⅰ.世界最早工業生成純堿的方法是路布蘭(N.Leblanc)法,其流程如圖1。
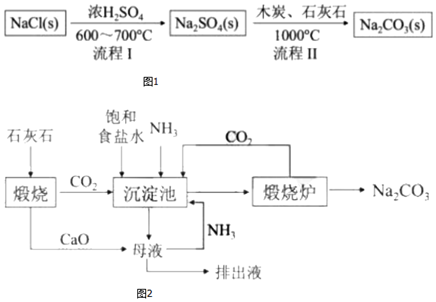
(1)流程Ⅰ的反應是反應非氧化還原非氧化還原(填“氧化還原”或“非氧化還原”),流程Ⅱ的反應是分步進行的,
a.Na2SO4(s)與過量木炭反應生成Na2S(s);
b.Na2S(s)與石灰石發生復分解反應生成Na2CO3,a步的反應化學方程式為Na2SO4+4C 1000℃ Na2S+4CO↑;Na2SO4+4C 1000℃ Na2S+4CO↑;。
Ⅱ.19世紀60年代后生產純堿的路布蘭法被索爾維(E.Solvay)氨堿法所取代,其生產流程如圖2。
(2)氨堿法中加入NH3的主要作用是NH3與水反應使溶液顯堿性,增大CO2的溶解量和HCO3-的濃度NH3與水反應使溶液顯堿性,增大CO2的溶解量和HCO3-的濃度。
(3)與路布蘭法相比,氨堿法的優點有原料利用充分、成本較低、對設備腐蝕小原料利用充分、成本較低、對設備腐蝕小。(寫出一條即可)
Ⅲ.1939年侯德榜首先提出并自行設計了聯合制堿法--利用合成氨工業上的NH3和CO2和NaCl為原料生產純堿。
(4)侯德榜制堿法的關鍵還在于對從反應后的混合物中分離出NaHCO3后所得溶液的處理:在溶液中加入NaCl固體并通入NH3,并在0~10℃0~10℃(填溫度范圍)下析出NH4Cl。
表不同溫度下NaCl和NH4Cl的溶解度數據(g/100g水)
1000
℃
1000
℃
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
【考點】純堿工業(侯氏制堿法).
【答案】非氧化還原;Na2SO4+4C Na2S+4CO↑;;NH3與水反應使溶液顯堿性,增大CO2的溶解量和HCO3-的濃度;原料利用充分、成本較低、對設備腐蝕小;0~10℃
1000
℃
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:33引用:2難度:0.7
相似題
-
1.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△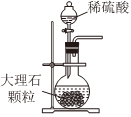
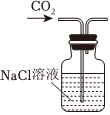
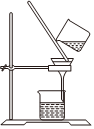
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發布:2024/12/8 18:0:1組卷:164引用:5難度:0.8 -
2.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
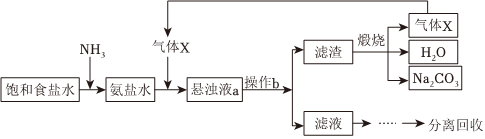
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發布:2024/12/8 0:0:1組卷:132引用:4難度:0.7 -
3.氨堿法(索氏)和聯合制堿法(侯氏)是兩大重要的工業制堿法,下列表達正確的是( )
氨堿法 聯合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產物 氯化鈣 氯化銨 C 循環物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


