2020-2021學年黑龍江省牡丹江一中高三(上)開學化學試卷
發布:2024/4/20 14:35:0
一.選擇題(每題只有一個正確答案,每題2分,共50分)
-
1.下列過程不涉及氧化還原反應的是( )
A.金屬的冶煉 B.濕潤的紅色布條遇到氯氣褪色 C.明礬凈水 D.刻蝕印刷電路板 組卷:40引用:1難度:0.6 -
2.下列關于物質的用途說法不正確的是( )
A.氧化鋁用作耐火材料 B.小蘇打用于食品膨松劑 C.純堿用于中和胃酸過多 D.氯氣可用于自來水消毒 組卷:9引用:1難度:0.8 -
3.縱觀古今,化學與生活皆有著密切聯系。下列說法錯誤的是( )
A.唐末《真元妙道要略》中有云:“以硫黃、雄黃合硝石并蜜燒之;焰起,燒手面及燼屋舍者”,文中描述的是黑火藥的制作過程。 B.《天工開物》記載:“凡白土曰堊土,為陶家精美器用”。陶是一種傳統硅酸鹽材料。 C.《夢溪筆談》中“取精鐵鍛之百余火……則純鋼也,雖百煉。不耗矣。”百煉鋼熔點比純鐵低。 D.《本草圖經》在綠礬項載:“蓋此礬色綠,味酸,燒之則赤……”。因為綠礬能電離出H+,所以有“味酸”。 組卷:19引用:1難度:0.8 -
4.下列關于物質的分類中,正確的是( )
酸性氧化物 酸 堿 鹽 混合物 電解質 A SiO2 HClO 純堿 明礬 CuSO4?5H2O CO2 B Na2O2 HNO3 生石灰 NaHSO4 漂白粉 Mg C SO3 H2SiO3 燒堿 碳酸氫鈉 水玻璃 NaCl D NO Al(OH)3 熟石灰 BaCO3 液氯 NH3 A.A B.B C.C D.D 組卷:280引用:4難度:0.6 -
5.下列說法正確的一組是( )
①不溶于水的鹽都是弱電解質
②可溶于水的鹽都是強電解質
③0.5mol?L-1一元酸溶液中H+濃度為0.5mol?L-1
④強酸溶液中的H+濃度不一定大于弱酸溶液中的H+濃度
⑤電解質溶液導電的原因是溶液中有自由移動的陰陽離子
⑥熔融的電解質都能導電A.①③⑤⑥ B.只有④⑤ C.②④⑤⑥ D.只有③⑥ 組卷:197引用:6難度:0.8 -
6.NA是阿伏加德羅常數的值。下列說法正確的是( )
A.12g石墨烯和12g金剛石均含有NA個碳原子 B.標準狀況下,11.2L的SO3中含1.5NA個氧原子 C.22.4L(標準狀況)氮氣中含有7NA個中子 D.常溫常壓下,100g 46%的乙醇水溶液中含O-H鍵總數目為NA 組卷:17引用:1難度:0.6 -
7.下列圖示實驗不正確的是( )
A. 
比較碳酸鈉和碳酸氫鈉的熱穩定性B. 
除去粗鹽中的不溶性雜質C. 
配制0.10mol/L的氯化鈉溶液D. 
提純氫氧化鐵膠體組卷:7引用:2難度:0.5 -
8.下列有關物質的工業制法中,錯誤的是( )
A.制硅:用焦炭還原二氧化硅得硅 B.制鈉:以海水為原料制得NaCl,再電解熔融NaCl得鈉 C.制鐵:以焦炭和鐵礦石為原料,用CO還原鐵礦石得鐵 D.制鋁:以鋁土礦為原料,經一系列過程制得AlCl3,再電解熔融AlCl3得鋁 組卷:22引用:3難度:0.8 -
9.下列說法不正確的是( )
A.既有單質參加又有單質生成的反應不一定是氧化還原反應 B.焰色反應是物理變化,實驗中用稀硫酸洗鉑絲或光潔無銹的鐵絲 C.鋁制餐具不宜用來蒸煮或長時間存放酸性或堿性食物 D.FeCl2、NaHCO3、Fe(OH)3都能通過用化合反應制得 組卷:29引用:1難度:0.8
二、填空題(共50分)
-
28.純堿是玻璃、制皂、造紙、紡織和漂染等工業的基本原料。
Ⅰ.世界最早工業生成純堿的方法是路布蘭(N.Leblanc)法,其流程如圖1。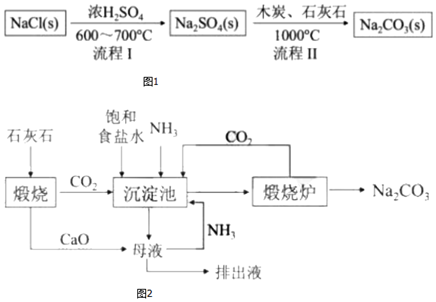
(1)流程Ⅰ的反應是反應(填“氧化還原”或“非氧化還原”),流程Ⅱ的反應是分步進行的,
a.Na2SO4(s)與過量木炭反應生成Na2S(s);
b.Na2S(s)與石灰石發生復分解反應生成Na2CO3,a步的反應化學方程式為。
Ⅱ.19世紀60年代后生產純堿的路布蘭法被索爾維(E.Solvay)氨堿法所取代,其生產流程如圖2。
(2)氨堿法中加入NH3的主要作用是。
(3)與路布蘭法相比,氨堿法的優點有。(寫出一條即可)
Ⅲ.1939年侯德榜首先提出并自行設計了聯合制堿法--利用合成氨工業上的NH3和CO2和NaCl為原料生產純堿。
(4)侯德榜制堿法的關鍵還在于對從反應后的混合物中分離出NaHCO3后所得溶液的處理:在溶液中加入NaCl固體并通入NH3,并在(填溫度范圍)下析出NH4Cl。
表不同溫度下NaCl和NH4Cl的溶解度數據(g/100g水)0℃ 10℃ 20℃ 30℃ 40℃ NaCl 35.7 35.8 36.0 36.3 36.6 NH4Cl 29.4 33.3 37.2 41.4 45.8 組卷:33引用:2難度:0.7 -
29.某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(1)分別取一定量氯化鐵、氯化亞鐵固體,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量鐵屑,其目的是。
(2)甲組同學取2mLFeCl2溶液。加入幾滴氯水,再加入1滴KSCN溶液,溶液變紅,說明Cl2可將Fe2+氧化。FeCl2溶液與氯水反應的離子方程式為。
(3)乙組同學認為甲組的實驗不夠嚴謹,該組同學在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入幾滴氯水和1滴KSCN溶液,溶液變紅,煤油的作用是。
(4)丙組同學取10mL 0.1mol/LKI溶液,加入6mL 0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3 支試管中進行如下實驗:
①第一支試管中加入1mLCCl4充分振蕩、靜置,CCl4層呈紫色;
②第二支試管中加入1滴K3[Fe(CN)6]溶液,生成藍色沉淀;
③第三支試管中加入1滴KSCN溶液,溶液變紅。
實驗②檢驗的離子是(填離子符號);實驗①和③說明:在I-過量的情況下,溶液中仍含有(填離子符號),由此可以證明該氧化還原反應為。
(5)丁組同學向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,發生反應的離子方程式為;一段時間后,溶液中有氣泡出現,并放熱,隨后有紅褐色沉淀生成。產生氣泡的原因是;生成沉淀的原因是(用平衡移動原理解釋)。組卷:1734引用:21難度:0.5


