探究一:為除去銅片中混有的少量鐵片,并測定該混合物中鐵的質量分數,現有如下A、B兩組實驗方案。
A:稱取一定質量的樣品加入足量的稀鹽酸攪拌過濾、洗滌、干燥、稱量所得固體質量
B:稱取一定質量的樣品加入足量的硫酸銅溶液攪拌過濾、洗滌、干燥、稱量所得固體質量
(1)兩種方案,你認為不能達到目的的是BB(填“A”或“B”),理由是生成的銅蓋在鐵片表面,使鐵不能完全反應生成的銅蓋在鐵片表面,使鐵不能完全反應。
(2)在你所選取的方案中,若采用加熱烘干的方式干燥濾渣,會導致測定的鐵的質量分數偏小偏小(填“偏大”、“偏小”、“不變”或“無法判斷”)。
探究二:某化學實驗小組同學將鐵粉投入硫酸銅溶液中,發現生成紅色固體物質的同時有較多的氣泡放出。生成的是什么氣體呢?同學們決定進行探究。探究前老師提示,該反應生成的氣體只有一種。
【提出猜想】放出的氣體可能是SO2、O2、H2,提出猜想的依據是質量守恒定律質量守恒定律。
【查閱資料】SO2易溶于水,化學性質與二氧化碳有相似之處,它能使澄清石灰水變渾濁,生成CaSO3。
【方案設計】依據上述猜想,實驗小組同學分別設計了如下方案:
(1)甲同學認為是O2,則檢驗方法是用帶火星的木條用帶火星的木條。
(2)乙同學認為是SO2,則只需將放出的氣體通入澄清石灰水中,看澄清石灰水是否變渾濁。寫出SO2與Ca(OH)2反應的化學方程式SO2+Ca(OH)2═CaSO3+H2OSO2+Ca(OH)2═CaSO3+H2O。
(3)實驗小組同學合作設計了如下組合實驗方案,排除和驗證猜想的氣體。
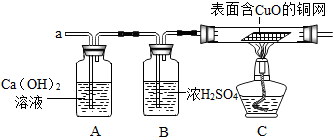
實驗過程中發現A裝置中溶液不變渾濁,C裝置中表面含CuO的銅網由黑色變為光亮的紅色。
【實驗結論】鐵粉與硫酸銅溶液反應時,產生的氣體是H2H2。
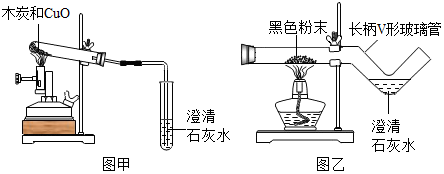
探究三:在銅的冶煉史中我國勞動人民有一項重大發明是“濕法冶金”。在五千年前我國勞動人民還會使用木炭煉銅。在化學實驗室里模擬煉銅,既可用傳統的實驗裝置(見圖甲),又能用改進的微型實驗裝置(見圖乙)。化學興趣小組采用圖乙裝置,開展以下探究活動:
【提出問題】木炭與CuO反應所得紅色固體中含有什么物質?
【查閱資料】
(1)木炭與CuO的反應是:C+2CuO 高溫 2Cu+CO2↑,若該反應進行的不徹底,產物中還有氧化亞銅(Cu2O)
(2)Cu2O是紅色固體,能與稀硫酸反應:Cu2O+H2SO4═Cu+CuSO4+H2O
作出猜想】紅色固體的成分:
①全部是Cu;②全部是Cu2O;③是Cu和Cu2O的混合物是Cu和Cu2O的混合物。
【實驗探究】
(1)取木炭、CuO兩種黑色粉末適量,再取少許CaCl2(能降低反應溫度,加快反應速率)均勻混合,然后將黑色粉末裝入長柄V形玻璃管的直管內。
(2)按圖乙連好實驗裝置,然后加熱反應物;2分鐘后,黑色粉末出現紅熱現象,同時澄清的石灰水變渾濁變渾濁,此時停止加熱。
(3)待玻璃管冷卻后,提取里面的紅色固體,進行如下的驗證:
加入足量的稀鹽酸
攪拌
加入足量的硫酸銅溶液
攪拌
高溫
| 步驟 | 現象 | 結論 |
| ①取1.44g紅色固體裝入試管,滴入足量的 稀硫酸 稀硫酸 ,充分反應 |
紅色固體部分減少,溶為變為 藍 藍 色 |
猜想 ① ① 錯誤 |
| ②濾出試管中殘留的紅色固體,洗滌干燥,稱其質量為1.04g | / | 猜想 ③ ③ 正確 |
使用圖乙裝置與使用圖甲裝置相比,其優點是
節約藥品
節約藥品
(寫出1條即可)。【答案】B;生成的銅蓋在鐵片表面,使鐵不能完全反應;偏小;質量守恒定律;用帶火星的木條;SO2+Ca(OH)2═CaSO3+H2O;H2;是Cu和Cu2O的混合物;變渾濁;稀硫酸;藍;①;③;節約藥品
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:108引用:2難度:0.5
相似題
-
 1.家庭廚房就是一個充盈的化學小世界,“柴米油鹽醬醋糖”中包含著許多化學內容.
1.家庭廚房就是一個充盈的化學小世界,“柴米油鹽醬醋糖”中包含著許多化學內容.
(1)米、面的主要成分都是由三種元素組成的淀粉,淀粉屬于糖類.
(2)水瓶內的水垢主要成分是碳酸鈣,可用(填一種調味品)除去.
(3)白糖與紅糖主要成分都是蔗糖.利用活性炭的性,可將紅糖脫色成白糖.
(4)市場上銷售的香腸、鹽水鴨、榨菜、豆腐干等食品,常采用真空包裝,其目的是防止食品而變質.
(5)味精是烹制菜肴時常用的調味品,小明研究某品牌味精包裝上的部分文字說明后,想測定此味精中氯化鈉的含量.
[查閱資料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸鈉的存在不影響NaCl性質.
[實驗過程]
①稱取該味精樣品10.0g,并溶于蒸餾水
②加入過量的硝酸銀溶液,過濾
③用蒸餾水反復洗滌沉淀多次
④將沉淀烘干、稱量,測得固體質量為5.74g
根據上述實驗步驟回答下列有關問題:
①過濾操作所需要的儀器除燒杯、鐵架臺(帶鐵圈)、玻璃棒外,還需要的玻璃儀器是.
②試通過計算確定此樣品中NaCl質量分數與其包裝上標注的含量是否相符.發布:2025/1/6 8:0:1組卷:68引用:2難度:0.5 -
2.化學興趣小組同學們在老師的指導下對市售某品牌“鈣片”的補鈣原理、成分以及功效展開了項目化學習的探究。
【查閱資料】
(1)該補鈣劑的主要成分有碳酸鈣、維生素D3、硫酸鋅、水果香料等。
(2)維生素D3、水果香料都不溶于水也不與酸反應,維生素D3主要作用是促進人體對鈣的吸收。
項目一:探究“鈣片”補鈣原理。
【分析交流】
“鈣片”中鈣以碳酸鈣形式存在,“鈣片”進入胃首先要通過人體胃酸對其進行溶解后方可被吸收。
【進行實驗】
【反思評價】服用“鈣片”時,采用實驗方案 實驗現象 實驗結論或化學方程式 取適量“鈣片”粉末于試管中,滴加足量 。化學方程式 (填“吞服”或“嚼服”)的服藥方式更有利促進胃腸吸收。
項目二:探究“鈣片”中是否含有硫酸鋅。
項目三:探究“鈣片”的功效。實驗方案 實驗現象 實驗結論 另取少量“鈣片”粉末于試管中,加足量水,充分溶解,取適量上層清液于試管中,加入幾滴 。“鈣片”中含有硫酸鋅。
【交流討論】
該補鈣劑適用于中老年人治療因缺鈣導致的患者。老師建議大家應注意平時的飲食補鈣,牛奶、魚類等食物除富含營養素外,是較好的補鈣食物,應該多食用。發布:2025/1/3 16:0:5組卷:30引用:1難度:0.5 -
 3.酸、堿、鹽種類繁多,與人類生活和生產關系密切。請回答下列問題:
3.酸、堿、鹽種類繁多,與人類生活和生產關系密切。請回答下列問題:
(1)造紙業會產生大量含NaOH的堿性廢水,需經處理至中性排放。
①寫出NaOH的俗稱:(一個即可)。
②若某造紙廠廢水中NaOH的質量分數為1.6%,現有廢硫酸9.8t(H2SO4的質量分數為10%)。可以處理的廢水質量為t。
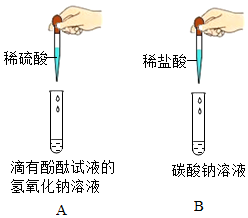
(2)某化學興趣小組做了如圖所示的兩個實驗。完成A、B兩個實驗后,同學們將實驗后的廢液傾倒入一個廢液缸中,發現廢液呈紅色,小組同學對廢液成分展開了如下探究。(該題實驗過程中所用溶液濃度較低;氯化鈣溶液和氯化鋇溶液顯中性;實驗中如涉及硫酸鈣、氫氧化鈣等微溶物,均可看做可溶物)
【交流討論】小組同學經討論分析后一致認為廢液中一定含有的溶質有氯化鈉和(酚酞除外)。
【提出猜想】廢液中還含有的物質:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化學式)。
【實驗驗證】
甲同學取少量廢液于試管中,向其中加入過量的氯化鈣溶液,通過觀察現象,得出了正確結論。若猜想二正確,甲同學觀察到的現象:有白色沉淀生成,;請寫出發生反應的化學方程式:。
【交流與反思】乙同學認為,將甲同學實驗中的氯化鈣溶液換成氯化鋇溶液,也能得出正確結論。你認為乙同學的觀點是否正確并說明你的理由:。發布:2025/1/3 8:0:1組卷:94引用:1難度:0.5


