當今,世界多國相繼規劃了碳達峰、碳中和的時間節點。因此,研發二氧化碳利用技術,降低空氣中二氧化碳含量成為研究熱點。
(1)大氣中的二氧化碳主要來自于煤、石油及其他含碳化合物的燃燒。已知25℃時,相關物質的燃燒熱數據如表:
| 物質 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃燒熱△H/(kJ?mol-1) | -286 | -394 | -3268 |
6C(石墨,s)+3H2(g)=C6H6(l) ΔH=+46kJ mol-1
6C(石墨,s)+3H2(g)=C6H6(l) ΔH=+46kJ mol-1
。(2)一氧化碳與氫氣的反應歷程如圖,其中吸附在催化劑表面上的物種用*標注。

①該反應歷程中控速步驟的能壘為
0.8
0.8
eV。②寫出虛線框內發生的化學反應方程式
H3CO*+H2=CH3OH*
1
2
H3CO*+H2=CH3OH*
。1
2
(3)105℃時,將足量的某碳酸氫鹽(MHCO3)固體置于真空恒容容器中,存在如下平衡:2MHCO3(s)
△
100.8
100.8
kPa。(4)我國科學家研究Li-CO2電池,取得了重大科研成果,回答下列問題:
Li-CO2電池中,Li為單質鋰片,則該電池中的CO2在
正
正
(填“正”或“負”)極發生電化學反應。研究表明,該電池反應產物為碳酸鋰和單質碳,且CO2電還原后與鋰離子結合形成碳酸鋰按以下4個步驟進行,寫出步驟Ⅲ的離子方程式。Ⅰ.2CO2+2e-═C2O42-
Ⅱ.C2O42-═CO2+CO22-
Ⅲ.
2 CO22-+CO2=2 CO32-+C
2 CO22-+CO2=2 CO32-+C
Ⅳ.CO32-+2Li+═Li2CO3
【答案】6C(石墨,s)+3H2(g)=C6H6(l) ΔH=+46kJ mol-1;0.8;H3CO*+H2=CH3OH*;100.8;正;2 CO22-+CO2=2 CO32-+C
1
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:23引用:3難度:0.6
相似題
-
1.肼(N2H4)可作為發射火箭的燃料。已知1g液態肼(N2H4)氣體在空氣中燃燒生成氮氣和水蒸氣,放出16.7kJ的熱量,該反應的熱化學方程式是( )
A.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-16.7kJ?mol-1 B.N2H4(l)+O2(g)═2H2O(l)+N2(g),△H=-534.4kJ?mol-1 C.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-534.4kJ?mol-1 D.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=+534.4kJ?mol-1 發布:2024/12/30 3:0:4組卷:121引用:9難度:0.6 -
2.氫在地球上主要以化合態的形式存在,是宇宙中分布最廣泛的物質,它構成了宇宙質量的75%,屬于二次能源.工業上生產氫的方式很多,常見的有水電解制氫,煤炭氣化制氫,重油及天然氣水蒸氣催化制氫等.氫氣是一種理想的綠色能源,如圖1為氫能產生和利用的途徑:
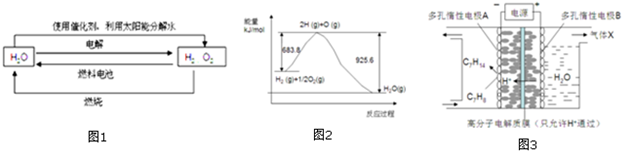
(1)圖1的四個過程中能量轉化形式有
A.2種 B.3種 C.4種 D.4種以上
(2)電解過程要消耗大量的電能,而使用微生物作催化劑在陽光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通電2H2(g)+O2(g)△H2光照催化劑
以上反應的△H1△H2(選填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依據圖2能量變化寫出氫氣燃燒生產液態水的熱化學方程式
(4)氫能利用需要選擇合適的儲氫材料.
①NaBH4是一種重要的儲氫載體,能與水反應生成NaBO2,且反應前后B的化合價不變,該反應的化學方程式為
②鑭鎳合金在一定條件下可吸收氫氣生產氫化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)釋放出氣態氫,根據平衡移動的原理,可改變的條件之一是
③一定條件下,如圖3所示裝置可實現有機物的電化學儲氫,使C7H8轉化為C7H14,則電解過程中產生的氣體X 為,電極A上發生的電極反應式為.發布:2024/12/17 8:0:2組卷:38引用:1難度:0.5 -
3.在298K、1.01×105Pa下,將0.5mol CO2通入750mL 1mol?L-1NaOH溶液中充分反應,測得反應放出xkJ的熱量。已知在該條件下,1mol CO2通入1L 2mol?L-1NaOH溶液中充分反應放出ykJ的熱量,則CO2與NaOH溶液反應生成NaHCO3的熱化學方程式正確的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2y-x)kJ?mol-1 B.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2x-y)kJ?mol-1 C.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(4x-y)kJ?mol-1 D.2CO2(g)+2NaOH(l)═2NaHCO3(l)ΔH=-(8x-2y)kJ?mol-1 發布:2024/12/30 4:0:1組卷:143引用:5難度:0.7


