化學(xué)小組用雙液原電池原理研究酸堿性對(duì)物質(zhì)氧化性、還原性強(qiáng)弱的影響。通過(guò)改溶液酸堿性,觀察電壓表讀數(shù)的變化,讀數(shù)越大,則對(duì)應(yīng)物質(zhì)的氧化性(或還原性)越強(qiáng)。
已知:①電壓高低主要與電極反應(yīng)有關(guān),還與溶液的溫度、離子的濃度、pH值等因素有關(guān)。
②MnO-4的還原產(chǎn)物與溶液酸堿性有關(guān),在強(qiáng)酸性溶液中,被還原為Mn2+;在中性和弱堿性溶液中,被還原為MnO2;在強(qiáng)堿性溶液中,被還原為MnO2-4。
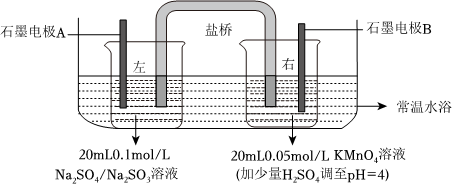
(1)連接電壓表,形成閉合回路,測(cè)得初始電壓為V1。實(shí)驗(yàn)裝置要置于水浴內(nèi)的原因:保證溶液的溫度不變,防止對(duì)實(shí)驗(yàn)造成干擾保證溶液的溫度不變,防止對(duì)實(shí)驗(yàn)造成干擾。
實(shí)驗(yàn)操作和讀數(shù)記錄如下:
M
n
O
-
4
M
n
O
2
-
4
| 左燒杯(Na2SO4/Na2SO3) | 右燒杯(KMnO4,調(diào)pH=4) | 電壓表讀數(shù)變化 | |
| ① | 逐滴加入5mL0.05mol/LH2SO4 | 由V1逐漸降低 | |
| ② | 逐滴加入5mL0.1mol/LNaOH | 由V1逐漸升高 | |
| ③ | 逐滴加入5mL0.05mol/LH2SO4 | 由V1逐漸升高 | |
| ④ | 加入少量0.1mol/LNaOH | 由V1略微下降 | |
| 繼續(xù)逐滴加入NaOH至5mL | 再迅速下降 |
溶液堿性增強(qiáng),Na2SO3的還原性增強(qiáng)
溶液堿性增強(qiáng),Na2SO3的還原性增強(qiáng)
。(3)同學(xué)乙認(rèn)為實(shí)驗(yàn)①中,加入酸后,還原劑轉(zhuǎn)化成了
NaHSO3
NaHSO3
(填化學(xué)式)。(4)同學(xué)丙認(rèn)為實(shí)驗(yàn)設(shè)計(jì)不夠嚴(yán)謹(jǐn),以實(shí)驗(yàn)①②為例,應(yīng)該往左邊燒杯中加入
5mL的蒸餾水或加入5mL0.05mol/LNa2SO4
5mL的蒸餾水或加入5mL0.05mol/LNa2SO4
,測(cè)得電壓為V2,以此作為實(shí)驗(yàn)①②的初始電壓。(5)同學(xué)丁認(rèn)為,實(shí)驗(yàn)③加入5mLH2SO4溶液后,右邊燒杯內(nèi)的電極反應(yīng)為:
M
n
O
-
4
M
n
O
-
4
實(shí)驗(yàn)④加入5mLNaOH溶液后,右邊燒杯內(nèi)的電極反應(yīng)為:
M
n
O
-
4
M
n
O
2
-
4
M
n
O
-
4
M
n
O
2
-
4
【考點(diǎn)】原電池原理.
【答案】保證溶液的溫度不變,防止對(duì)實(shí)驗(yàn)造成干擾;溶液堿性增強(qiáng),Na2SO3的還原性增強(qiáng);NaHSO3;5mL的蒸餾水或加入5mL0.05mol/LNa2SO4;+8H++5e-=Mn2++4H2O;+e-=
M
n
O
-
4
M
n
O
-
4
M
n
O
2
-
4
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/10/25 1:0:1組卷:38引用:1難度:0.5
相似題
-
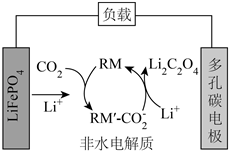 1.我國(guó)某科研團(tuán)隊(duì)借助氧化還原介質(zhì)RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說(shuō)法正確的是( )
1.我國(guó)某科研團(tuán)隊(duì)借助氧化還原介質(zhì)RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說(shuō)法正確的是( )A.LiFePO4電極的電勢(shì)比多孔碳電極的高 B.負(fù)極反應(yīng):LiFePO4-xe-═Li(1-x)FePO4+xLi+ C.RM和RM′- 均為該電池反應(yīng)的催化劑CO-2D.LiFePO4電極每減重7g,就有22gCO2被固定 發(fā)布:2024/12/20 4:30:1組卷:156引用:2難度:0.5 -
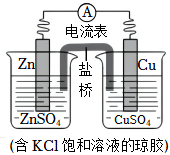 2.銅鋅原電池的裝置如圖,其中鹽橋?yàn)閮?nèi)含KCl的瓊脂凝膠,下列說(shuō)法不正確的是( )
2.銅鋅原電池的裝置如圖,其中鹽橋?yàn)閮?nèi)含KCl的瓊脂凝膠,下列說(shuō)法不正確的是( )A.Zn是負(fù)極反應(yīng)物,發(fā)生氧化反應(yīng) B.電子從鋅片流向銅片 C.銅電極上發(fā)生反應(yīng)Cu2++2e-═Cu D.鹽橋中Cl-進(jìn)入CuSO4溶液 發(fā)布:2024/12/15 19:30:1組卷:195引用:1難度:0.5 -
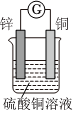 3.如圖所示將鋅、銅通過(guò)導(dǎo)線相連,置于硫酸銅溶液中。
3.如圖所示將鋅、銅通過(guò)導(dǎo)線相連,置于硫酸銅溶液中。
(1)該裝置將轉(zhuǎn)化為能。
(2)Zn電極為極,發(fā)生反應(yīng),電極方程式為。
(3)外電路電子由電極經(jīng)導(dǎo)線流向電極。
(4)若反應(yīng)過(guò)程中鋅溶解了6.5g,則銅電極增重g,該回路中轉(zhuǎn)移的電子數(shù)為。發(fā)布:2024/12/30 3:0:4組卷:315引用:2難度:0.7


