2023-2024學年廣東省深圳市富源學校高二(上)期中化學試卷
發布:2024/10/25 1:0:1
一、選擇題(1-10每題2分,11-16每題4分,共44分)
-
1.下列反應屬于放熱反應的是( )
A.C+CO2 2CO△B.濃硫酸溶于水 C.鎂與稀鹽酸的反應 D.石灰石分解制備氧化鈣 組卷:5引用:1難度:0.7 -
 2.下列反應屬于非氧化還原反應,且能量變化與圖示能量相符合的是( )
2.下列反應屬于非氧化還原反應,且能量變化與圖示能量相符合的是( )A.Ca(OH)2與稀H2SO4反應 B.氫氣與氮氣的化合反應 C.灼熱的炭與CO2反應 D.Ba(OH)2?8H2O晶體與NH4Cl晶體反應 組卷:119引用:6難度:0.7 -
3.下列熱化學方程式正確的是( )
選項 已知條件 熱化學方程式 A H2的燃燒熱為akJ?mol-1 H2+Cl2═2HCl ΔH=-akJ?mol-1 B 1molSO2、0.5molO2完全反應后,放出熱量98.3kJ 2SO2(g)+O2(g)?2SO3(g)ΔH=-98.3kJ?mol-1 C H+(aq)+OH-(aq)═H2O(l)
ΔH=-57.3kJ?mol-1H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)ΔH=-114.6kJ?mol-1 D 31g白磷(P4)比31g紅磷(P)能量多bkJ P4(s)=4P(s)ΔH=-4bkJ?mol-1 A.A B.B C.C D.D 組卷:107引用:17難度:0.5 -
4.N2(g)+3H2(g)?2NH3(g)ΔH<0。反應達平衡時,下列措施能提高N2轉化率的是( )
①降溫②恒壓通入惰性氣體③增加N2的濃度④加壓⑤催化劑A.①④ B.①② C.②⑤ D.③④ 組卷:32引用:5難度:0.5 -
5.已知:NO2(g)+SO2(g)?SO3(g)+NO(g)。現將體積之比為1:2的NO2和SO2的混合氣體置于密閉恒容的容器中發生上述反應,下列能說明反應達到平衡狀態的是( )
A.混合氣體總物質的量保持不變 B.混合氣體密度保持不變 C.NO2(g)和SO2(g)的濃度保持不變 D.每消耗1molSO2,同時消耗0.5molSO3(g) 組卷:32引用:4難度:0.7 -
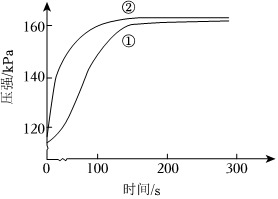 6.在兩個密閉的錐形瓶中,0.05g形狀相同的鎂條(過量)分別與2mL2mol?L-1的鹽酸和醋酸反應,測得容器內壓強隨時間的變化曲線如圖。下列說法不正確的是( )
6.在兩個密閉的錐形瓶中,0.05g形狀相同的鎂條(過量)分別與2mL2mol?L-1的鹽酸和醋酸反應,測得容器內壓強隨時間的變化曲線如圖。下列說法不正確的是( )A.曲線②代表醋酸與鎂條反應 B.反應開始時,鹽酸與Mg反應的更快 C.反應結束時兩容器內n(H2)基本相等 D.反應過程中鹽酸c(H+)下降更快 組卷:22引用:6難度:0.6
二、非選擇題(共56分)
-
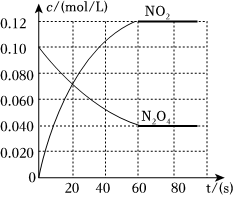 19.在容積為2.0L的密閉容器中,通入一定量的N2O4,發生反應:N2O4(g)?2NO2(g)。
19.在容積為2.0L的密閉容器中,通入一定量的N2O4,發生反應:N2O4(g)?2NO2(g)。
100℃時,各物質濃度隨時間變化如圖所示。
(1)60s內,v(N2O4)=。
(2)下列敘述中,能說明該反應達到化學平衡狀態的是(填字母序號)。
A.NO2的生成速率是N2O4的生成速率的2倍
B.單位時間內消耗amolN2O4,同時生成2amolNO2
C.容器內的壓強不再變化
D.容器內混合氣體的密度不再變化
(3)降低溫度,混合氣體的顏色變淺,正反應是反應(填“放熱”或“吸熱”)。
(4)欲提高N2O4的平衡轉化率,理論上可以采取的措施為。
A.增大壓強
B.升高溫度
C.加入催化劑
(5)100℃時,該反應的化學平衡常數的表達式為,數值為。
(6)平衡時,N2O4的轉化率是。
(7)100℃時,在容器中按初始濃度c(N2O4)=0.10mol/L、c(NO2)=0.10mol/L投料,反應進行(填“正向”或“逆向”)。組卷:13引用:2難度:0.6 -
20.化學小組用雙液原電池原理研究酸堿性對物質氧化性、還原性強弱的影響。通過改溶液酸堿性,觀察電壓表讀數的變化,讀數越大,則對應物質的氧化性(或還原性)越強。
已知:①電壓高低主要與電極反應有關,還與溶液的溫度、離子的濃度、pH值等因素有關。
②的還原產物與溶液酸堿性有關,在強酸性溶液中,被還原為Mn2+;在中性和弱堿性溶液中,被還原為MnO2;在強堿性溶液中,被還原為MnO-4。MnO2-4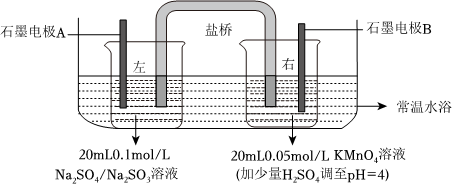
(1)連接電壓表,形成閉合回路,測得初始電壓為V1。實驗裝置要置于水浴內的原因:。
實驗操作和讀數記錄如下:
(2)同學甲根據實驗③推導出酸性增強,KMnO4的氧化性增強,實驗②可以得出:左燒杯(Na2SO4/Na2SO3) 右燒杯(KMnO4,調pH=4) 電壓表讀數變化 ① 逐滴加入5mL0.05mol/LH2SO4 由V1逐漸降低 ② 逐滴加入5mL0.1mol/LNaOH 由V1逐漸升高 ③ 逐滴加入5mL0.05mol/LH2SO4 由V1逐漸升高 ④ 加入少量0.1mol/LNaOH 由V1略微下降 繼續逐滴加入NaOH至5mL 再迅速下降 。
(3)同學乙認為實驗①中,加入酸后,還原劑轉化成了(填化學式)。
(4)同學丙認為實驗設計不夠嚴謹,以實驗①②為例,應該往左邊燒杯中加入,測得電壓為V2,以此作為實驗①②的初始電壓。
(5)同學丁認為,實驗③加入5mLH2SO4溶液后,右邊燒杯內的電極反應為:。
實驗④加入5mLNaOH溶液后,右邊燒杯內的電極反應為:。組卷:38引用:1難度:0.5


