某同學在用稀硫酸與鋅制取氫氣的實驗中,發現加入少量硫酸銅溶液可加快氫氣的生成速率.請回答下列問題:
(1)上述實驗中發生反應的化學方程式有CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;
(2)硫酸銅溶液可以加快氫氣生成速率的原因是CuSO4與Zn反應產生的Cu與Zn形成Cu-Zn-稀硫酸原電池,CuSO4與Zn反應產生的Cu與Zn形成Cu-Zn-稀硫酸原電池,加快了氫氣產生的速率加快了氫氣產生的速率;
(3)實驗室中現有Na2SO4、MgSO4、Ag2SO4、K2SO4等4種溶液,可與上述實驗中CuSO4溶液起相似作用的是Ag2SO4Ag2SO4;
(4)為了進一步研究硫酸銅的量對氫氣生成速率的影響,該同學設計了如下一系列的實驗.將表中所給的混合溶液分別加入到6個盛有過量Zn粒的反應瓶中,收集產生的氣體,記錄獲得相同體積的氣體所需的時間.
| 實驗 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 飽和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
30
30
,V6=10
10
,V9=17.5
17.5
.②反應一段時間后,實驗A中的金屬呈
灰黑
灰黑
色,實驗E中的金屬呈暗紅
暗紅
色;③該同學最后得出的結論為:當加入少量CuSO4溶液時,生成氫氣的速率會大大提高,但當加入的CuSO4溶液超過一定量時,生成氫氣的速率反而會下降.請分析氫氣生成速率下降的主要原因
當加入一定量的CuSO4后,生成的單質Cu會沉積在Zn的表面,降低了Zn與溶液的接觸面積
當加入一定量的CuSO4后,生成的單質Cu會沉積在Zn的表面,降低了Zn與溶液的接觸面積
.【考點】探究影響化學反應速率的因素.
【答案】CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;CuSO4與Zn反應產生的Cu與Zn形成Cu-Zn-稀硫酸原電池,;加快了氫氣產生的速率;Ag2SO4;30;10;17.5;灰黑;暗紅;當加入一定量的CuSO4后,生成的單質Cu會沉積在Zn的表面,降低了Zn與溶液的接觸面積
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:15引用:2難度:0.5
相似題
-
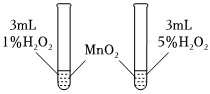 1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應速率的因素是( )
1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應速率的因素是( )A.催化劑 B.溫度 C.濃度 D.壓強 發布:2024/12/30 14:0:1組卷:44引用:3難度:0.6 -
2.為探究影響化學反應速率的因素,某研究小組設計了如下五個實驗。按要求回答下列問題(已知:Cu2+、Fe3+對H2O2的分解起催化作用)。
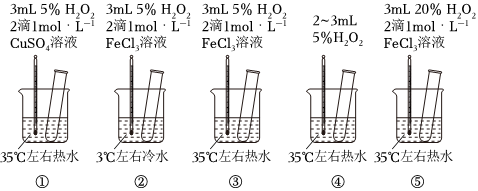
(1)為探究溫度對化學反應速率的影響,應選擇實驗(填序號,下同),選擇的依據是。
(2)為探究催化劑對化學反應速率的影響,同時探究催化劑不同催化效果不同,應選擇實驗。
(3)通過觀察發現實驗⑤比實驗③現象明顯,其原因是。
(4)根據上述實驗,用H2O2快速制取少量O2,可采取的三條措施為。發布:2024/12/30 14:30:1組卷:8引用:5難度:0.5 -
 3.(一)Fenton法常用于處理含有難降解有機物的工業廢水,通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物.現運用該方法降解有機污染物p-CP,探究有關因素對該降解反應速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設計如下對比實驗(其余實驗條件見下表):
3.(一)Fenton法常用于處理含有難降解有機物的工業廢水,通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物.現運用該方法降解有機污染物p-CP,探究有關因素對該降解反應速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設計如下對比實驗(其余實驗條件見下表):
(1)編號③的實驗目的是實驗序號 實驗目的 T/K pH c/10-3mol?L-1 H2O2 Fe2+ ① 為以下實驗作參照物 298 3 6.0 0.30 ② 探究溫度對降解反應速率的影響 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
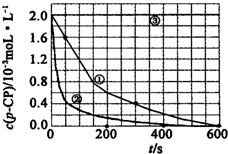
(2)實驗測得不同實驗編號中p-CP的濃度隨時間變化的關系如圖所示.請根據實驗①曲線,計算降解反應在50-300s內的平均反應速率v(p-CP)=.
(3)實驗①②表明,溫度與該降解反應速率的關系是.
(二)已知Fe3+和I-在水溶液中的反應為2I-+2Fe3+=2Fe2++I2.正向反應速率和I-、Fe3+的濃度關系為v=kcm(I-)cn(Fe3+)(k為常數)
(4)請分析下表提供的數據回答以下問題:
①在v=kcm(I-)cn(Fe3+)中,m、n的值為c(I-)/(mol?L-1) c(Fe3+)/(mol?L-1) v/(mol?L-1?s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(選填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-濃度對反應速率的影響Fe3+濃度對反應速率的影響(填“<”、“>”或“=”).
(三)一定溫度下,反應FeO(s)+CO(g)?Fe(s)+CO2(g)的化學平衡常數為3.0,該溫度下將2mol FeO、4mol CO、5mol Fe、6mol CO2加入容積為2L的密閉容器中反應.請通過計算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若將5mol FeO、4mol CO加入同樣的容器中,在相同溫度下達到平衡,則CO的平衡轉化率為.發布:2024/12/30 14:30:1組卷:19引用:2難度:0.5


