2021-2022學(xué)年陜西省西安一中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題每小題2分共46分。每小題只有一個(gè)選項(xiàng)符合題意)
-
1.化學(xué)與人類生活、社會(huì)可持續(xù)發(fā)展密切相關(guān),下列說(shuō)法正確的是( )
A.直接燃燒煤和將煤進(jìn)行深加工后再燃燒的效率相同 B.天然氣、水能屬于一級(jí)能源,水煤氣、電能屬于二級(jí)能源 C.人們可以把放熱反應(yīng)釋放的能量轉(zhuǎn)化為其它可利用的能量,而吸熱反應(yīng)沒(méi)有利用價(jià)值 D.地?zé)崮堋L(fēng)能、天然氣和氫能都屬于新能源 組卷:45引用:6難度:0.7 -
2.在氣體反應(yīng)中,能使反應(yīng)物中活化分子數(shù)和活化分子百分?jǐn)?shù)都增大的方法有( )
①增大反應(yīng)物的濃度
②升高溫度
③增大壓強(qiáng)
④加入催化劑A.①②③④ B.②④ C.②③ D.①② 組卷:20引用:6難度:0.7 -
3.下列有關(guān)反應(yīng)速率說(shuō)法正確的是( )
A.在酶催化淀粉水解反應(yīng)中,溫度越高淀粉水解速率越快 B.為加快鐵和水蒸氣的反應(yīng)速率,增加反應(yīng)物鐵的用量(不考慮表面積變化) C.FeCl3和MnO2均可加快H2O2分解,同等條件下二者對(duì)H2O2分解速率的改變相同 D.在稀硫酸和鐵粉反應(yīng)制氫氣時(shí),為減慢反應(yīng)速率,可加入適量醋酸鈉固體 組卷:6引用:2難度:0.7 -
4.下列各組物質(zhì)全部是弱電解質(zhì)的是( )
A.H2O、NH3?H2O、H3PO4、HF B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa C.H2SO3、Ba(OH)2、BaSO4 D.SO2、H2S、CO2 組卷:156引用:9難度:0.7 -
5.從植物花汁中提取的一種有機(jī)物,可簡(jiǎn)化表示為HIn,在水溶液中因存在下列電離平衡,故可用作酸、堿指示劑:HIn(紅色)?H++In-(黃色)。在上述溶液中加入適量下列物質(zhì),最終能使指示劑顯黃色的是( )
A.鹽酸 B.NaHCO3溶液 C.NaHSO4溶液 D.NaClO(固體) 組卷:19引用:6難度:0.8 -
6.已知相同條件下,HClO的電離常數(shù)小于H2CO3的第一級(jí)電離常數(shù)(Ka1),為了提高氯水中HClO的濃度,可行的是( )
A.加入CaCO3(s) B.通入HCl(g) C.加入H2O D.加入NaOH(s) 組卷:40引用:3難度:0.9 -
7.室溫下,將1mol的CuSO4?5H2O(s)溶于水會(huì)使溶液溫度降低,熱效應(yīng)為△H1;將1mol的CuSO4(s)溶于水會(huì)使溶液溫度升高,熱效應(yīng)為△H2,CuSO4?5H2O受熱分解的化學(xué)方程式為:CuSO4?5H2O(s)
CuSO4(s)+5H2O(l),熱效應(yīng)為△H3。則下列判斷正確的是( )△A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3 組卷:222引用:12難度:0.5 -
8.下列事實(shí)中,不能應(yīng)用化學(xué)平衡移動(dòng)原理來(lái)解釋的是( )
①可用濃氨水和NaOH固體快速制氨氣
②用兩個(gè)惰性電極電解CuCl2溶液,溶液顏色變淺:CuCl2Cu+Cl2電解
③開(kāi)啟啤酒瓶后,瓶中馬上泛起大量泡沫
④溴水中有下列平衡Br2+H2O?HBr+HBrO,當(dāng)加入少量硝酸銀固體后,溶液顏色變淺
⑤對(duì)于反應(yīng)2HI(g)?H2(g)+I2(g)達(dá)平衡后,縮小容器體積可使體系顏色變深A.①②③ B.②④⑤ C.②⑤ D.③④⑤ 組卷:46引用:7難度:0.6
二、填空題
-
25.某同學(xué)在用稀硫酸與鋅制取氫氣的實(shí)驗(yàn)中,發(fā)現(xiàn)加入少量硫酸銅溶液可加快氫氣的生成速率.請(qǐng)回答下列問(wèn)題:
(1)上述實(shí)驗(yàn)中發(fā)生反應(yīng)的化學(xué)方程式有;
(2)硫酸銅溶液可以加快氫氣生成速率的原因是;
(3)實(shí)驗(yàn)室中現(xiàn)有Na2SO4、MgSO4、Ag2SO4、K2SO4等4種溶液,可與上述實(shí)驗(yàn)中CuSO4溶液起相似作用的是;
(4)為了進(jìn)一步研究硫酸銅的量對(duì)氫氣生成速率的影響,該同學(xué)設(shè)計(jì)了如下一系列的實(shí)驗(yàn).將表中所給的混合溶液分別加入到6個(gè)盛有過(guò)量Zn粒的反應(yīng)瓶中,收集產(chǎn)生的氣體,記錄獲得相同體積的氣體所需的時(shí)間.
①請(qǐng)完成此實(shí)驗(yàn)設(shè)計(jì),其中:V1=實(shí)驗(yàn)
混合溶液A B C D E F 4mol?L-1H2SO4/mL 30 V1 V2 V3 V4 V5 飽和CuSO4溶液/mL 0 0.5 2.5 5 V6 20 H2O/mL V7 V8 V9 V10 10 0 ,V6=,V9=.
②反應(yīng)一段時(shí)間后,實(shí)驗(yàn)A中的金屬呈色,實(shí)驗(yàn)E中的金屬呈色;
③該同學(xué)最后得出的結(jié)論為:當(dāng)加入少量CuSO4溶液時(shí),生成氫氣的速率會(huì)大大提高,但當(dāng)加入的CuSO4溶液超過(guò)一定量時(shí),生成氫氣的速率反而會(huì)下降.請(qǐng)分析氫氣生成速率下降的主要原因.組卷:15引用:2難度:0.5 -
26.運(yùn)用化學(xué)反應(yīng)原理研究碳、氮的單質(zhì)及其化合物的反應(yīng)對(duì)緩解環(huán)境污染、能源危機(jī)具有重要意義。
(1)反應(yīng):N2(g)+O2(g)?2NO(g)ΔH1=+180.5kJ?mol-1
2NO(g)+2CO(g)?N2(g)+2CO2(g)ΔH2。
已知CO的燃燒熱為283.0 kJ?mol-1,則ΔH2=。
(2)升高溫度絕大多數(shù)的化學(xué)反應(yīng)速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率卻隨著溫度的升高而減小。某化學(xué)小組為研究該特殊現(xiàn)象的實(shí)質(zhì)原因,查閱資料知2NO(g)+O2(g)?2NO2(g)的反應(yīng)歷程分兩步:
Ⅰ.2NO(g)?N2O2(g)(快);v1正=k1正?c2(NO);v1逆=k1逆?c(N2O2)ΔH1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正?c(N2O2)c(O2);v2逆=k2逆?c2(NO2)ΔH2<0
請(qǐng)回答下列問(wèn)題:
①一定溫度下,反應(yīng)2NO(g)+O2(g)?2NO2(g)達(dá)到平衡狀態(tài),請(qǐng)寫(xiě)出用k1正、k1逆、k2正、k2逆表示的平衡常數(shù)表達(dá)式K=。
②決定2NO(g)+O2(g)?2NO2(g)速率的是反應(yīng)(填“Ⅰ”或“Ⅱ”),反應(yīng)Ⅰ的活化能E1與反應(yīng)Ⅱ的活化能E2的大小關(guān)系為E1E2(填“>”、“<”或“=”)。根據(jù)速率方程分析,升高溫度該反應(yīng)速率減小的原因是。
A.k2正增大,c(N2O2)增大
B.k2正減小,c(N2O2)減小
C.k2正增大,c(N2O2)減小
D.k2正減小,c(N2O2)增大
(3)在一定溫度下向容積為2L的密閉容器中加入0.5molNO、0.5molCO,此時(shí)容器總壓為P0kPa,發(fā)生反應(yīng)2NO(g)+2CO(g)?N2(g)+2CO2(g),4min時(shí)達(dá)平衡,此時(shí)測(cè)得氮?dú)獾奈镔|(zhì)的量為0.2mol,用平衡分壓表示的平衡常數(shù)KP=(某氣體的分壓=氣體總壓強(qiáng)×該氣體的體積分?jǐn)?shù)(或物質(zhì)的量分?jǐn)?shù))用含有P0的代數(shù)式表示)。
(4)在密閉容器中充入5molCO和4molNO,發(fā)生反應(yīng)2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH=-746.5kJ?mol-1,圖1為平衡時(shí)NO的體積分?jǐn)?shù)與溫度、壓強(qiáng)的關(guān)系。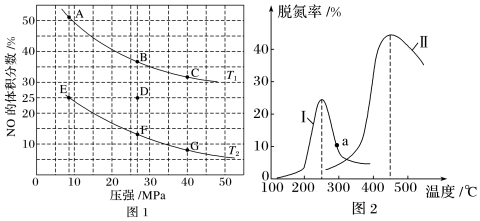
①溫度:T1(填“<”或“>”) T2。
②若在D點(diǎn)對(duì)反應(yīng)容器升溫的同時(shí)擴(kuò)大體積使體系壓強(qiáng)減小,重新達(dá)到的平衡狀態(tài)可能是圖中A~G點(diǎn)中的點(diǎn)。
③某研究小組探究催化劑對(duì)CO、NO轉(zhuǎn)化的影響。將NO和CO以一定的流速通過(guò)兩種不同的催化劑進(jìn)行反應(yīng),相同時(shí)間內(nèi)測(cè)量逸出氣體中NO含量,從而確定尾氣脫氮率(脫氮率即NO的轉(zhuǎn)化率),結(jié)果如圖2所示。若低于200℃,圖2中曲線Ⅰ脫氮率隨溫度升高而變化不大的主要原因?yàn)?;a點(diǎn)(填“是”或“不是”)對(duì)應(yīng)溫度下的平衡脫氮率,說(shuō)明其理由。組卷:35引用:1難度:0.9


