 H2O2廣泛應用于化學品合成、紙漿和紡織品的漂白,是環保型液體漂白劑.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2廣泛應用于化學品合成、紙漿和紡織品的漂白,是環保型液體漂白劑.有研究表明,H2O2溶液的漂白性是HO2-所致.
(1)H2O2溶液顯弱酸性,測得0.15mol?L-1H2O2溶液pH約為6.寫出H2O2生成HO2-的電離方程式:H2O2?HO2-+H+H2O2?HO2-+H+.
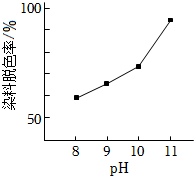
(2)其他條件相同時,研究不同初始pH條件下H2O2溶液的漂白效果,結果如下:由圖可得到的結論是 其他條件相同時,初始pH越大染料脫色率越高,即H2O2的漂白效果越好其他條件相同時,初始pH越大染料脫色率越高,即H2O2的漂白效果越好,結合平衡移動原理簡述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移動,c(HO2-)增大c(OH-)增大,促使H2O2?HO2-+H+正向移動,c(HO2-)增大.
(3)實驗發現:若pH>11,則H2O2溶液的漂白效果隨pH增大而降低.針對這一現象,繼續進行實驗,發現溶液中H2O2的分解與pH有關.測定不同初始pH條件下,初始濃度均為0.15mol?L-1的H2O2溶液發生分解反應,結果如表:
| 初始pH | pH=10 | pH=12 |
| 1小時后H2O2溶液濃度 | 0.13mol?L-1 | 0.07mol?L-1 |
| 1小時后pH | 沒有明顯變化 | 沒有明顯變化 |
①結合離子方程式解釋1小時后pH沒有明顯變化的原因:
堿性條件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反應的催化劑,故反應前后pH不變
堿性條件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反應的催化劑,故反應前后pH不變
.②從反應速率的角度分析pH過大,H2O2溶液漂白效果會降低的原因:
pH過大,H2O2分解過快,使參與漂白的c(HO2-)下降,故漂白效果降低
pH過大,H2O2分解過快,使參與漂白的c(HO2-)下降,故漂白效果降低
.【考點】化學平衡移動原理.
【答案】H2O2?HO2-+H+;其他條件相同時,初始pH越大染料脫色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2?HO2-+H+正向移動,c(HO2-)增大;堿性條件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反應的催化劑,故反應前后pH不變;pH過大,H2O2分解過快,使參與漂白的c(HO2-)下降,故漂白效果降低
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:129引用:6難度:0.3
相似題
-
1.下列事實能用勒夏特列原理解釋的是( )
A.硫酸氫鈉溶液的pH值小于7 B.久制的氨水pH值變小 C.合成氨工廠通常采用500℃高溫,以提高原料的利用率 D.過氧化氫分解加氯化鐵溶液作催化劑,使單位時間內產生的氧氣的量多 發布:2024/12/20 8:0:1組卷:10引用:1難度:0.9 -
2.下列事實不能用夏勒特列原理解釋的是( )
A.用FeCl3晶體配制溶液時,先將其溶于較濃鹽酸中 B.紅棕色的NO2氣體,加壓后顏色先變深后變淺 C.合成氨工業中使用鐵觸媒作催化劑 D.對熟石灰的懸濁液加熱,懸濁液中固體質量增加 發布:2024/12/7 0:30:1組卷:43引用:2難度:0.8 -
3.下列事實不能用勒夏特列原理解釋的是( )
A.工業合成氨時,適當提高N2濃度,以提高H2的轉化率 B.對平衡體系2NO2?N2O4(g),縮小容器的體積,混合氣體的顏色突然加深 C.實驗室可用排飽和NaCl溶液的方法收集Cl2 D.用稀鹽酸洗滌AgCl沉淀比用等體積的蒸餾水洗滌損失的AgCl少 發布:2024/11/29 16:0:2組卷:15引用:3難度:0.7


