納米TiO2?2H2O作為一種重要的無機氧化物材料,因其在電子、化纖、廢水處理等諸多領域的應用而備受關注。如圖是利用NH3、TiCl4、正丁醇—水制備納米TiO2?2H2O的簡易裝置。

(1)請寫出利用上圖裝置制備氨氣的化學方程式:CaO+NH3?H2O=Ca(OH)2+NH3↑CaO+NH3?H2O=Ca(OH)2+NH3↑。
(2)干燥管內盛裝的物質是 堿石灰堿石灰,其作用為 干燥氨氣干燥氨氣。
(3)實驗過程:i.將160mL蒸餾水、鹽酸(4mL)和正丁醇混合于三頸燒瓶中,形成乳濁液,置于冰水浴中。
ii.向三頸燒瓶中緩慢滴加10mLTiCl4,然后組裝好裝置。
ⅲ.不斷攪拌并緩緩通入NH3至pH=3時停止。
①在水中的溶解度:正丁醇 小于小于(填“大于”“等于”或“小于”)乙醇;
②TiCl4容易發生水解,生成TiO2?2H2O,由于顆粒太大不符合實驗要求,請寫出TiCl4水解反應方程式:TiCl4+4H2O?TiO2?2H2O+4HClTiCl4+4H2O?TiO2?2H2O+4HCl;實驗中使用的鹽酸濃度為6mol/L,實驗室配制該濃度溶液時使用的玻璃儀器有:燒杯、玻璃棒、膠頭滴管、一定規格的容量瓶和 量筒量筒;本實驗中鹽酸的作用有 抑制TiCl4水解(或降低水解速率)抑制TiCl4水解(或降低水解速率)、可以用測定pH的方法來確定終點可以用測定pH的方法來確定終點;
③實驗中需不斷攪拌,主要目的是充分混合正丁醇與水,使正丁醇把水切割、包圍在非常小的區域,這樣做的目的是 ACAC(填序號);
A.降低水解速率
B.使正丁醇完全溶于水
C.有利于形成TiO2?2H2O納米結構
D.降低鹽酸的溶解性
④實驗中不能使用溫水浴的主要原因是 溫度高,水解速率增大;只得到大顆粒TiO2?2H2O,不能得到納米結構的TiO2?2H2O溫度高,水解速率增大;只得到大顆粒TiO2?2H2O,不能得到納米結構的TiO2?2H2O。
【考點】制備實驗方案的設計.
【答案】CaO+NH3?H2O=Ca(OH)2+NH3↑;堿石灰;干燥氨氣;小于;TiCl4+4H2O?TiO2?2H2O+4HCl;量筒;抑制TiCl4水解(或降低水解速率);可以用測定pH的方法來確定終點;AC;溫度高,水解速率增大;只得到大顆粒TiO2?2H2O,不能得到納米結構的TiO2?2H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:4引用:1難度:0.6
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如圖:
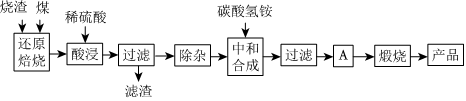
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是;當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.
(5)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:114引用:4難度:0.5 -
2.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
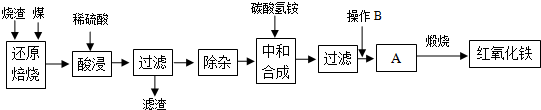
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗
Fe3+已經除盡的試劑是.
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是.
(5)煅燒A的反應方程式是.
(6)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:5引用:1難度:0.5 -
3.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
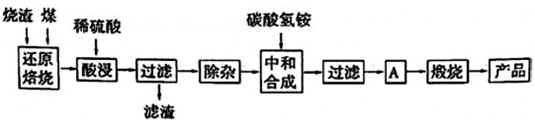
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常溫下,當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.5


