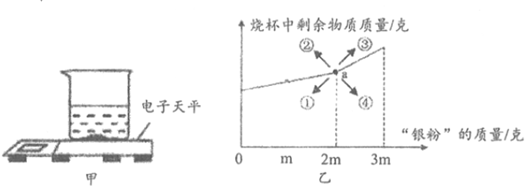
“銀粉”常用作化工顏料的添加劑。通過調查,小明知道“銀粉”可能是銀或鋁。為探究“銀粉”的成分,小明購買了某廠家的“銀粉”進行實驗,將一定量的“銀粉”放在燒杯中,放在電子天平上,向其中加入稀鹽酸(如圖甲)。
(1)小明觀察到 有無色氣泡產生且“銀粉”全部溶解有無色氣泡產生且“銀粉”全部溶解現象,說明“銀粉”是金屬鋁。
(2)若要測定“銀粉”中金屬的相對原子質量,從而確定“銀粉”中的金屬是鋁,則在實驗中應該測量的數據是 加入“銀粉“的質量,加入稀鹽酸的質量,燒杯中剩余物質的總質量加入“銀粉“的質量,加入稀鹽酸的質量,燒杯中剩余物質的總質量。
(3)長期放置,“銀粉”中的鋁可能被部分氧化,小明取一定量的的“銀粉”分三次加入相同質量的稀鹽酸中,記錄每次燒杯中剩余物質的總質量,并繪制成如圖乙所示曲線。圖乙中,a點表示燒杯中的稀鹽酸恰好完全反應。若“銀粉”中的鋁被氧化程度越大,則a點的位置會向①②③④中哪個方向移到,并說明理由 a點的位置會向圖中的③方向移動,理由是:設分別與含HCl質量為y的稀鹽酸恰好完全反應的鋁和氧化鋁反應后溶液增加的質量分別為a和b,則。
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
21954-6=ya
a=16y73
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
219102=yb
b=34y73
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動a點的位置會向圖中的③方向移動,理由是:設分別與含HCl質量為y的稀鹽酸恰好完全反應的鋁和氧化鋁反應后溶液增加的質量分別為a和b,則。
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
21954-6=ya
a=16y73
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
219102=yb
b=34y73
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動。
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
219
54
-
6
=
y
a
a=
16
y
73
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
219
102
=
y
b
b=
34
y
73
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
219
54
-
6
=
y
a
a=
16
y
73
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
219
102
=
y
b
b=
34
y
73
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動
【考點】金屬的化學性質;相對原子質量的概念及其計算方法.
【答案】有無色氣泡產生且“銀粉”全部溶解;加入“銀粉“的質量,加入稀鹽酸的質量,燒杯中剩余物質的總質量;a點的位置會向圖中的③方向移動,理由是:設分別與含HCl質量為y的稀鹽酸恰好完全反應的鋁和氧化鋁反應后溶液增加的質量分別為a和b,則。
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
a=
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
b=
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動
2Al+6HCl=2AlCl3+3H2↑△m(2Al-3H2)
219 54-6
y a
219
54
-
6
=
y
a
a=
16
y
73
2Al+6HCl=2AlCl3+3H2↑△m(Al2O3)
219 102
y b
219
102
=
y
b
b=
34
y
73
分析可知,a<b,故a可能向②③移動;再分析與等量HCl反應需鋁和氧化鋁的質量,根據上述化學方程式,與6個HCl反應的Al和Al2O3的個數分別為2和1,所以與6個HCl反應的鋁和氧化鋁的質量比=54:102=9:17,說明氧化得越厲害,恰好完全反應時的“銀粉”質量越大,所以若銀粉中鋁被氧化的程度越大,a點的位置會向圖中的③方向移動
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:23引用:3難度:0.5
相似題
-
1.“自熱火鍋”給我們的生活帶來一定的便利。小龍同學就某種自熱火鍋的“自熱”原理產生了興趣,查閱到的相關資料如下:
①自熱火鍋食用方法:下層底盒中倒入適量冷水,打開加熱包塑料膜,將加熱包放入涼水中:放上上層食材盒,倒入一定食用冷水,蓋上蓋子,15分鐘后,即可開蓋食用。(圖乙為自熱火鍋結構示意圖)
②加熱包內含有鐵粉、鋁粉、焦炭粉、生石灰等物質,其中的金屬粉末與炭粉在熱水中發生化學反應,可短時間放出大量的熱,后續緩慢放熱。
③自熱火鍋工作時,下層加熱盒中空氣溫度隨時間變化的圖像如圖丙所示。
為解釋自熱火鍋的工作原理,請結合上述材料,對oa、ab、bc各段的溫度變化做出解釋:。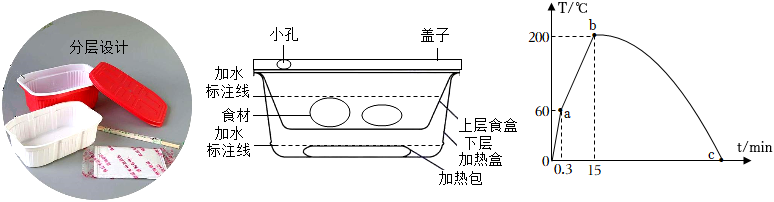 發布:2024/12/28 14:0:1組卷:40引用:2難度:0.5
發布:2024/12/28 14:0:1組卷:40引用:2難度:0.5 -
2.將等量的Mg、Fe、Zn三種金屬分別放入質量和溶質質量分數均相同的三份稀硫酸中,反應完成后,生成氫氣的質量關系不可能的是( )
A. 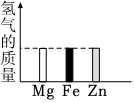
B. 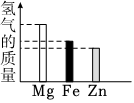
C. 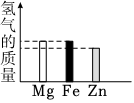
D. 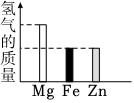 發布:2024/12/28 15:30:1組卷:35引用:3難度:0.5
發布:2024/12/28 15:30:1組卷:35引用:3難度:0.5 -
3.如圖甲所示為探究鐵釘銹蝕條件的實驗,如圖乙所示為用稀鹽酸除鐵釘表面的鐵銹的實驗。回答問題:
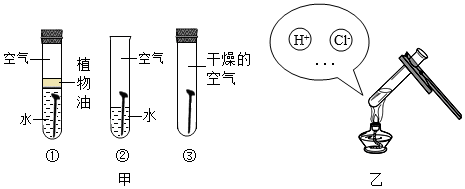
(1)如圖甲所示實驗,若實驗結果是試管①③中的鐵釘不生銹,試管②中鐵釘生銹;則可得出鐵釘生銹的條件是:。
(2)如圖乙所示實驗,若觀察到試管中鐵釘變得光亮且表面有氣泡生成,溶液呈黃色;此時溶液中存在的微粒除H+和Cl-外,還有(不考慮H2O)。發布:2024/12/28 14:30:1組卷:56引用:7難度:0.5


