根據(jù)元素在體內(nèi)含量不同,可將體內(nèi)元素分為常量元素和微量元素。其中H、C、O、N、S、P等為常量元素,F(xiàn)e、Zn等為微量元素。回答下列問(wèn)題:
(1)基態(tài)Fe原子有77組相同能量的電子。
(2)數(shù)據(jù)表明,S的第一電離能小于P的第一電離能,其原因可能有兩種:一種是S失去的是已經(jīng)配對(duì)的電子,配對(duì)電子相互排斥,電離能較低,另一種是磷原子的3p軌道電子排布呈半充滿(mǎn)、穩(wěn)定狀態(tài),第一電離能較高磷原子的3p軌道電子排布呈半充滿(mǎn)、穩(wěn)定狀態(tài),第一電離能較高。
(3)NH3分子與Zn2+結(jié)合成配合物[Zn(NH3)4]2+,與游離的氨分子相比,其鍵角∠HNH較大較大(填“較大”,“較小”或“相同”),解釋原因NH3通過(guò)配位鍵與Zn2+結(jié)合后,原來(lái)的孤電子對(duì)變?yōu)槌涉I電子對(duì),對(duì)其他N-H成鍵電子對(duì)的排斥力減小,N-H鍵之間的鍵角增大NH3通過(guò)配位鍵與Zn2+結(jié)合后,原來(lái)的孤電子對(duì)變?yōu)槌涉I電子對(duì),對(duì)其他N-H成鍵電子對(duì)的排斥力減小,N-H鍵之間的鍵角增大。
(4)原子的電子親和能是指在0K下的氣相中,原子獲得電子變成負(fù)離子時(shí)所釋放的能量。氧原子的第二電子親和能(O-+e-→O2-的能量)不能直接在氣相中測(cè)定,但可通過(guò)如圖的born-Haber循環(huán)計(jì)算得到。
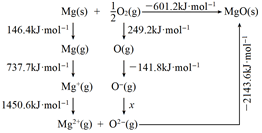
由圖可知,Mg原子的第一電離能為737.7737.7kJ?mol-1,O=O鍵鍵能為498.4498.4kJ?mol-1,氧原子的第二電子親和能x=-899.7-899.7kJ?mol-1。
(5)氫化鎂(MgH2)與金屬鋅在一定條件下研磨,可制得化合物Mg2ZnH4,X-射線衍射分析表明,該化合物的立方晶胞的面心和頂點(diǎn)均被鋅原子占據(jù),所有鎂原子的配位數(shù)都相等。
①該晶胞中鎂原子個(gè)數(shù)為88。
②已知Mg2ZnH4晶體的晶胞參數(shù)為apm,鎂原子分布在該晶胞中鋅原子形成的四面體中心。該晶胞中相鄰鎂原子與鋅原子之間距離為34a34apm,Mg2ZnH4晶體密度為468a3×NA×1030468a3×NA×1030g?cm-3(阿伏加德羅常數(shù)的值用NA表示)。
3
4
a
3
4
a
468
a
3
×
N
A
468
a
3
×
N
A
【答案】7;磷原子的3p軌道電子排布呈半充滿(mǎn)、穩(wěn)定狀態(tài),第一電離能較高;較大;NH3通過(guò)配位鍵與Zn2+結(jié)合后,原來(lái)的孤電子對(duì)變?yōu)槌涉I電子對(duì),對(duì)其他N-H成鍵電子對(duì)的排斥力減小,N-H鍵之間的鍵角增大;737.7;498.4;-899.7;8;;×1030
3
4
a
468
a
3
×
N
A
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:39引用:1難度:0.6
相似題
-
1.已知Al、Mg、Na為第三周期元素,其原子的第一至第四電離能如下表:
(1)則Al、Mg、Na的電負(fù)性從大到小的順序?yàn)?電離能/kJ?mol-1 I1 I2 I3 I4 X 578 1817 2745 11578 Y 738 1451 7733 10540 Z 496 4562 6912 9543 ;
(2)C、N、O、H是周期表中前10號(hào)元素,它們的原子半徑依次減小,H能分別與C、N、O形成電子總數(shù)相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取雜化;
②CH4是含有鍵(填“極性”或“非極性”)的分子(填“極性”或“非極性”);
③NH3是一種易液化的氣體,請(qǐng)簡(jiǎn)述其易液化的原因;
④H2O分子的VSEPR模型的空間構(gòu)型為,H2O分子的空間構(gòu)型為;
(3)K、Cr、Cu三種元素的原子序數(shù)依次增大,三原子的核外的最外層電子排布均為4s1。
①K元素組成的單質(zhì)的晶體堆積模型為(填代號(hào));
a.簡(jiǎn)單立方堆積
b.體心立方堆積
c.六方最密堆積
d.面心立方最密堆積
②Cr元素在其化合物中最高化合價(jià)為;
③Cu2+離子的核外電子排布式為。發(fā)布:2025/1/5 8:0:1組卷:3引用:1難度:0.7 -
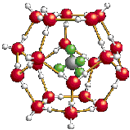 2.我國(guó)在青藏高原發(fā)現(xiàn)大儲(chǔ)量可燃冰.可燃冰的晶體結(jié)構(gòu)模型如圖:
2.我國(guó)在青藏高原發(fā)現(xiàn)大儲(chǔ)量可燃冰.可燃冰的晶體結(jié)構(gòu)模型如圖:
(1)C、N、O三種元素第一電離能由大到小的排列順序是>>(填元素符號(hào)),H2O分子中O原子的雜化方式為.
(2)“可燃冰”晶體內(nèi)部存在的作用力有.
(3)下列有關(guān)“可燃冰”的說(shuō)法中,不正確的是.
A.“可燃冰”的存在說(shuō)明甲烷易溶于水
B.“可燃冰”屬于分子晶體,熔點(diǎn)較低
C.相同條件下,“可燃冰”的密度比冰的大
D.“可燃冰”只能在低溫、高壓環(huán)境下穩(wěn)定存在
(4)晶體中平均每46個(gè)水分子構(gòu)成8個(gè)籠,每個(gè)籠可容納1個(gè)CH4分子或1個(gè)H2O分子,每8個(gè)籠中有6個(gè)容納CH4分子,2個(gè)籠填充H2O分子,則“可燃冰”(天然氣水合物)的平均組成可表示為.發(fā)布:2024/12/31 8:0:1組卷:23引用:1難度:0.3 -
3.鐵及其化合物在生產(chǎn)生活及科學(xué)研究方面應(yīng)用非常廣泛。
(1)基態(tài)Fe原子的價(jià)層電子的電子排布圖為,其最外層電子的電子云形狀為。
(2)(NH4)2Fe(SO4)2?6H2O俗稱(chēng)摩爾鹽。
①O、S兩元素的電負(fù)性由大到小的順序?yàn)?!--BA-->(用元素符號(hào)表示)。
②N、O兩元素的第一電離能由大到小的順序?yàn)?!--BA-->(用元素符號(hào)表示)。
③SO42-中S原子的雜化方式為,VSEPR模型名稱(chēng)為。
(3)Fe3+可與某陰離子發(fā)生特征的顯色反應(yīng),用于鑒定Fe3+.該陰離子的電子式為,σ鍵和π鍵的數(shù)目之比為。其空間構(gòu)型為。
(4)K3[Fe(CN)6]晶體中配離子的配位體為(用化學(xué)符號(hào)表示)發(fā)布:2025/1/5 8:0:1組卷:19引用:1難度:0.6
相關(guān)試卷


