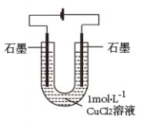
某化學小組同學利用如圖裝置對電解氯化銅實驗進行探究。
| 實驗裝置 | 實驗現象 |
|
電解約5min,陽極石墨表面產生大量氣泡,有刺激性氣味,溶液藍色稍微變淺;陰極石墨上附著紅色物質,溶液由藍色變為黃綠色;U型管變熱,冷卻后溶液仍為黃綠色。 |
①陽極的電極反應式為
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
。②測定電解5min時陽極溶液的pH=2.61,結合化學用語解釋溶液pH減小的原因是
Cl2+H2O?H++Cl-+HClO,c(H+)增大,pH減小
Cl2+H2O?H++Cl-+HClO,c(H+)增大,pH減小
。(2)探究陰極溶液變為黃綠色的原因
查閱資料:CuCl2溶液中存在平衡:Cu2++4H2O?[Cu(H2O)]2+((藍色);Cu2++4Cl-?[CuCl4]2-(黃色)。
①甲認為,電解過程中,溫度升高,促使化學平衡發生移動,[CuCl4]2-濃度增大,導致溶液由藍色變為黃綠色。但是他通過分析實驗現象否定了自己的假設,他的證據為
冷卻后溶液仍為黃綠色
冷卻后溶液仍為黃綠色
。②乙認為,電解過程中陰極發生反應:Cu2++e-+Cl-═CuCl↓且Cl-移向陽極的速率遠小于Cu2+在陰極放電的速率,導致陰極區
c
(
C
l
-
)
c
(
C
u
2
+
)
NaCl固體
NaCl固體
至飽和,溶液由藍色變為黃綠色。(3)實驗完成后,切斷電源,小組同學忘記將電極從溶液中取出,一段時間后,發現陰極石墨上析出的銅消失了,仔細觀察,并未看見固體沉積在U形管底部。對于“銅自動溶解之謎”,繼續探究。
①丙認為,Cu與CuCl2溶液發生反應生成[CuCl2]-使Cu溶解:Cu2++2Cl-+Cu═2CuCl↓(白色);CuCl+Cl-?[CuCl2]-。他通過實驗證實了自己的猜想,他的實驗方案為
取陰極附近的溶液,加入銅粉振蕩,先產生白色沉淀,后沉淀溶解
取陰極附近的溶液,加入銅粉振蕩,先產生白色沉淀,后沉淀溶解
。②丁認為,還可能是石墨電極與附著的銅構成了原電池使電極上附著的Cu溶解。并設計了如圖所示的裝置證明了自己的假設,請將裝置補充完整并寫出該電池總反應的離子方程式。
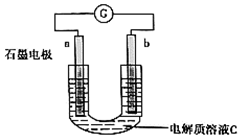
電極b為:
銅
銅
;電解質溶液C為:原電解池陰極附近的溶液
原電解池陰極附近的溶液
。電池總反應的離子方程式:
2Cu+O2+8Cl-+4H+=2[CuCl4]2-+2H2O
2Cu+O2+8Cl-+4H+=2[CuCl4]2-+2H2O
。【考點】電解原理的應用實驗.
【答案】2Cl--2e-=Cl2↑;Cl2+H2O?H++Cl-+HClO,c(H+)增大,pH減小;冷卻后溶液仍為黃綠色;NaCl固體;取陰極附近的溶液,加入銅粉振蕩,先產生白色沉淀,后沉淀溶解;銅;原電解池陰極附近的溶液;2Cu+O2+8Cl-+4H+=2[CuCl4]2-+2H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:85引用:1難度:0.4
相似題
-
 1.現需設計一套實驗裝置來電解飽和食鹽水,并測量電解產生的氫氣的體積(約6mL)和檢驗氯氣的氧化性(不應將多余的氯氣排入空氣中)。
1.現需設計一套實驗裝置來電解飽和食鹽水,并測量電解產生的氫氣的體積(約6mL)和檢驗氯氣的氧化性(不應將多余的氯氣排入空氣中)。
(1)試從如圖中選用幾種必要的儀器,連成一整套裝置,各種儀器接口的連接順序(填編號)是:
A接,接,B接,接。
(2)鐵棒接直流電源的極;碳棒上發生的電極反應為。
(3)能說明氯氣具有氧化性的實驗現象是。
(4)假定裝入的飽和食鹽水為50mL(電解前后溶液體積變化可忽略),當測得的氫氣換算成標準狀況下為5.6mL時,溶液的pH為。發布:2024/6/27 10:35:59組卷:42引用:4難度:0.5 -
 2.如圖所示,X為鐵、Y是石墨電極,a是飽和食鹽水,實驗開始前,在U形?管的兩邊同時各滴入幾滴酚酞試液,下列敘述錯誤的是( )
2.如圖所示,X為鐵、Y是石墨電極,a是飽和食鹽水,實驗開始前,在U形?管的兩邊同時各滴入幾滴酚酞試液,下列敘述錯誤的是( )A.合上K1、斷開K2,該裝置可以將化學能轉變為電能 B.合上K1、斷開K2,X是陰極,Y電極附近溶液慢慢變為紅色 C.合上K2、斷開K1,濕潤的KI淀粉試紙靠近Y電極管口,試紙變藍 D.合上K2、斷開K1,電解一段時間,X電極附近溶液呈紅色 發布:2024/5/27 14:0:0組卷:617引用:5難度:0.7 -
 3.如圖是某同學用Cu在Fe片上鍍銅的實驗裝置,下列說法正確的是( )
3.如圖是某同學用Cu在Fe片上鍍銅的實驗裝置,下列說法正確的是( )A.Cu2+在A極被還原 B.溶液藍色逐漸變淺 C.銅片連接A極,鐵制品連接B極 D.A極和B極直接相連,銅片被氧化 發布:2024/5/27 14:0:0組卷:504引用:3難度:0.7
相關試卷


